
Niels Henrik David Bohr (1885-1962) est né au Danemark à Copenhague, deuxième des trois enfants de Christian Bohr, professeur de physiologie à l'université. Après avoir obtenu son doctorat en 1911 à l'Université de Copenhague, Niels Bohr part travailler avec Joseph John Thomson à Cambridge, puis avec Ernst Rutherford à Manchester. Ce dernier avait montré dans son expérience de diffusion des particules alpha que l'atome est formé d'un noyau chargé positivement, de masse pratiquement égale à celle de l'atome, et d'électrons chargés négativement qui gravitent à grande distance autour du noyau. D’après les lois classiques, un tel système aurait été instable. Sous l'influence des idées de Max Planck, Niels Bohr propose le modèle atomique qui porte aujourd'hui son nom. Ce travail fut récompensé en 1922 par le Prix Nobel de physique.
En 1923, il affine le principe de correspondance, qu’il utilise largement dans son article de 1913 :
le comportement d'un système décrit par les lois de la physique quantique obéit aux lois de la physique classique si le système est suffisamment grand (1). En 1927, pour trouver un consensus entre la formulation de Heisenberg et celle de Schrödinger de la mécanique quantique, il énonce le principe de complémentarité onde-corpuscule. La même année, lors du congrès Solvay, il débat passionnément avec Albert Einstein au sujet du déterminisme statistique de la mécanique quantique, que ce dernier n'a jamais accepté. À partir des années 1930, Niels Bohr s'intéresse à la physique nucléaire. Il propose le modèle dit "de la goutte liquide" afin d'expliquer la structure du noyau et la fission nucléaire.
Niels Bohr est le fondateur de l'Institut de Physique Théorique de Copenhague, qui a formé une pléiade de jeunes scientifiques comme Heisenberg, Pauli, Dirac, Fermi, Oppenheimer, Gamow, Landau. Pendant la deuxième guerre mondiale, il se réfugie aux États-Unis où il participe au projet "Manhattan" de construction de la bombe atomique. Pendant la Guerre froide, il milite pour le partage des informations scientifiques et techniques sur les armes nucléaires comme garantie de la stabilité politique. Bohr joue également un rôle important dans la création du Conseil Européen de Recherche Nucléaire (CERN), le laboratoire européen de recherche en physique des particules.
L'hypothèse des quanta
À la fin du XIXe siècle, on pense que les découvertes en physique touchent à leur fin. On connaît la mécanique newtonienne, qui décrit avec précision les mouvements des astres, la thermodynamique et la physique statistique, qui montrent comment l'énergie se transforme d'une forme à l'autre, et la théorie électromagnétique, qui unifie l'électricité et le magnétisme et inclut de manière naturelle l'optique.
Le tableau de la physique semble complet et, selon l'expression du Lord Kelvin
(2), il ne reste que "deux petits nuages sur le ciel serein de la physique" : le milieu matériel dans lequel la lumière se propage et le problème du rayonnement du corps noir. Ces deux nuages vont se transformer en orages impressionnants, qui révolutionneront la physique : la théorie de la relativité et la mécanique quantique.
C'est du deuxième nuage que nous allons parler : le rayonnement du corps noir. Un corps chauffé à une température donnée émet des ondes électromagnétiques : une cheminée ou un fer à repasser, par exemple, radient de la chaleur sous forme d'ondes électromagnétiques. Comment se répartit la densité de l'énergie de l'onde électromagnétique en fonction de sa fréquence ? En d'autres termes, quelles sont les couleurs de la lumière émises par un corps incandescent ?
C'est à la fin du XIXe siècle que John William Strutt (Lord Rayleigh, 1842-1919) et James Hopwood Jeans (1877-1946) s'attaquent à ce problème. En prenant comme point de départ la physique classique, plus précisément la physique statistique de Boltzmann et la théorie électromagnétique de Maxwell, les deux physiciens déduisent une relation mathématique de la densité de l'énergie en fonction de la fréquence (loi dite de Rayleigh-Jeans), qui vérifie les résultats expérimentaux pour les basses fréquences. En revanche, la loi est fausse dans le domaine des grandes fréquences : selon Rayleigh et Jeans, la densité de l'énergie augmente indéfiniment avec la fréquence – un feu de cheminée devrait donc être une puissante source de rayons gamma, mortels en une fraction de seconde.
C'est finalement Max Planck qui en 1900, après des recherches acharnées, parvient à trouver une explication théorique aux résultats expérimentaux en émettant une hypothèse audacieuse, difficile à accepter dans le cadre de la physique classique : l'émission de la lumière ne se produit pas de manière continue mais par petits grains d'énergie, appelés quanta, dont les valeurs sont le produit de la fréquence multipliée par un nombre appelé la constante de Planck. C'est l'acte de naissance de la mécanique quantique.
En 1905, pour expliquer l'effet photoélectrique (l'émission d'électrons par la lumière, phénomène à la base du fonctionnement des cellules photovoltaïques), Albert Einstein émet une autre hypothèse : non seulement l'absorption et l'émission de la lumière sont discontinues, mais c'est la structure de la lumière elle-même qui est discrète, c'est-à-dire formée de corpuscules appelés photons. L'énergie d'un photon est égale au produit de sa fréquence multipliée par la constante de Planck. La lumière, qu'on associait depuis des siècles à un comportement ondulatoire, a aussi un comportement corpusculaire, comme les particules.
Le "plum pudding" de J. J. Thomson et le modèle de Rutherford
En 1897, Joseph John Thomson montre que l'atome n'est pas une particule élémentaire mais qu'il contient lui-même des particules négatives, appelées électrons. Quelques années plus tard, il établit le premier modèle de l'atome : les électrons, chargés négativement, sont immergés dans un nuage de charge positive uniforme, "comme des prunes dans un pudding
(3)". Thomson affine son modèle : à l'intérieur du noyau, les électrons tournent sur des orbites circulaires stabilisées par le fait que lorsqu'un électron s'éloigne du centre du nuage positif, il sent une force d'attraction proportionnelle à son éloignement, comme un ressort. Il essaie d'expliquer le spectre rayonné par l'atome comme résultat de l'énergie de diverses orbites : le résultat est mitigé.
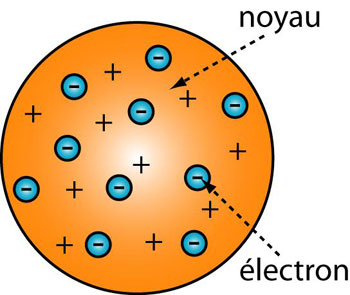
Figure 1 : Dans l'atome de Thomson, les électrons, chargés négativement sont immergés dans un nuage de charge positive uniforme qui est le noyau. (© Ilarion Pavel)
Mais en 1909, Geiger et Marsden
(4) bombardent une fine feuille d'or avec des particules alpha (noyau de l'atome d'hélium). La majorité des particules traverse la feuille d'or en subissant une légère déviation, mais certaines sont rejetées en arrière. Deux années plus tard, Rutherford arrive à la conclusion que ce phénomène ne peut se produire que si la charge positive est concentrée dans une petite partie centrale de l'atome, appelée noyau atomique, dont la taille est de l'ordre de 10
-14 m : l'atome est « en grande partie formé de vide
(5) ». Il propose alors un autre modèle de l'atome, selon lequel les électrons tournent autour du noyau comme les planètes gravitent autour du Soleil.

Figure 2 : Diffusion des particules alpha par un atome de type Thomson (à gauche) et par un atome de type Rutherford (à droite). Dans le premier cas, les charges électriques sont disséminées dans la masse de l'atome et donc les particules alpha ne sont pratiquement pas déviées ; dans le second certaines d'entre elles sont déviées à grand angle, par interaction avec la charge électrique concentrée dans le noyau. (© Ilarion Pavel).
L'atome de Bohr
Cependant le modèle atomique de Rutherford est instable. En effet, selon les lois de l'électromagnétisme, toute particule chargée ayant un mouvement accéléré émet un rayonnement électromagnétique. D'après ce modèle, les électrons, dans leur mouvement circulaire autour du noyau atomique, devraient donc émettre un rayonnement, perdre leur énergie et tomber sur le noyau atomique.
Ce problème conduit Niels Bohr à émettre en 1913 des hypothèses audacieuses : les orbites circulaires des électrons sont stables et leur rayon a une valeur fixe. C'est en émettant ou en absorbant un photon que l'électron peut passer d'une orbite à une autre. Bohr applique ces hypothèses à l'atome le plus simple, celui d'hydrogène, et son explication des niveaux d'énergie connaît un grand succès.
Encouragé par Rutherford, Bohr publie en 1913 un article en trois parties, intitulé "On the Constitution of Atoms and Molecules" et connu par la suite comme "La Trilogie". C'est la première partie
(6) de ce texte qui est commentée dans la suite du présent article.
@@@@@@@
Après une courte description de l'atome de Rutherford, Bohr souligne les insuffisances de ce modèle en opposition avec le modèle de Thomson, à savoir l'instabilité
(7) des électrons :
The principal difference between the atom-models proposed by Thomson and Rutherford consists in the circumstance the forces acting on the electrons in the atom-model of Thomson allow of certain configurations and motions of the electrons for which the system is in a stable equilibrium; such configurations, however, apparently do not exist for the second atom-model.
Le modèle de Rutherford ne contient aucune longueur spécifique
(8), il est donc incapable de prédire la taille des atomes, qui sont des paramètres introduits à la main dans la théorie :
among the quantities characterizing the first atom a quantity appears – the radius of the positive sphere [le rayon de l'atome de Thomson] – of dimensions of a length and of the same order of magnitude as the linear extension of the atom, while such a length [longueur spécifique] does not appear among the quantities characterizing the second atom, viz. the charges and masses of the electrons and the positive nucleus; nor can it be determined solely by help of the latter quantities.
Bohr annonce d'emblée l'essentiel : en renonçant aux lois classiques de l'électrodynamique et en faisant appel à la constante de Planck, on peut expliquer la stabilité de l'atome et, par une simple analyse dimensionnelle, obtenir une taille spécifique de l'atome, en conformité avec des données expérimentales :
[…] general acknowledgment of the inadequacy of the classical electrodynamics in describing the behaviour of systems of atomic size […] it seems necessary to introduce in the laws in question a quantity foreign to the classical electrodynamics, i.e. Planck's constant, or as it often is called the elementary quantum of action. By the introduction of this quantity the question of the stable configuration of the electrons in the atoms is essentially changed as this constant is of such dimensions and magnitude that it, together with the mass and charge of the particles, can determine a length of the order of magnitude required.
Dans cette première section de la "Trilogie", Bohr traite la façon dont l'électron est lié au noyau. Il considère un système simple, formé d'un noyau lourd, chargé positivement, et un électron, très léger, dont la vitesse est petite par rapport à celle de la lumière. Ces hypothèses sont raisonnables, le rapport entre la masse de l'électron et celle de l'atome d’hydrogène étant connu à l'époque. On peut donc considérer le noyau pratiquement fixe et appliquer la mécanique newtonienne pour étudier ce système.
La force d'interaction coulombienne entre l'électron et le noyau est inversement proportionnelle au carré de la distance qui les sépare, de manière analogue à la force gravitationnelle exercée par le soleil sur une planète. Le mouvement de l'électron autour du noyau est analogue au mouvement d'une planète autour du soleil, dont les équations étaient connues depuis deux siècles
(9).
Comme Bohr l'annonce, l'électron décrit une trajectoire elliptique, avec une fréquence de révolution (inverse de la période du mouvement) ω et un grand demi-axe a :
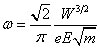
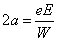 (1)
(1)
où W est l'énergie cinétique (égale dans ce cas à la valeur absolue de l'énergie totale) de l'électron, m sa masse, e et E les charges de l'électron et du noyau respectivement (10). Ces relations étaient bien connues depuis la résolution du problème à deux corps, dit de Kepler (voir l'appendice mathématique). Si on élimine l'énergie de ces deux équations, on en déduit la troisième loi de Kepler : le carré de la période est proportionnel au cube du grand demi-axe de l'ellipse.
La remarque de Bohr concernant l'absence d'une dimension spécifique est maintenant évidente : il n'existe aucune contrainte qui puisse limiter les valeurs de l'énergie W et du demi-grand axe a – celles-ci peuvent prendre toutes valeurs. C'est d'ailleurs pourquoi les dimensions des orbites des planètes et autres corps célestes occupent une si grande plage de valeurs. Cependant, conformément à l'électromagnétisme classique, toute particule chargée animée d'un mouvement accéléré émet du rayonnement, perd de l'énergie et tombe finalement sur le noyau. Or d'un point de vue expérimental, on n'observe pas ce phénomène :
[…] the electron will no longer describe stationary orbits. W will continuously increase, and the electron will approach the nucleus describing orbits of smaller and smaller dimensions, and with greater and greater frequency; the electron on the average gaining in kinetic energy at the same time as the whole system loses energy. This process will go on until the dimensions of the orbit are of the same order of magnitude as the dimensions of the electron or those of the nucleus. A simple calculation shows that the energy radiated out during the process considered will be enormously great compared with that radiated out by ordinary molecular processes.
Par la suite, Bohr simplifie mathématiquement le problème en considérant que l'électron ne se déplace que sur des orbites circulaires. Un électron, initialement situé au repos à grande distance du noyau (et dont l’énergie est donc nulle), s'approche du noyau et finalement se met en mouvement sur une orbite circulaire de rayon
a et d'énergie
(11) -
W. Dans ce processus, l'électron perd de l'énergie par rayonnement, et pour estimer cette énergie Bohr applique l'hypothèse de Planck : le rayonnement est émis par quanta d'énergie égaux à un multiple de
hν (où
h est une constante universelle, qui sera plus tard appelée constante de Planck, et
ν est la fréquence du rayonnement) :
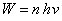 (2)
(2)
où n est un nombre entier, appelé plus tard nombre quantique principal (12).
Bohr fait l'hypothèse que la fréquence du rayonnement émis dans ce processus est égale à la moitié de la fréquence de rotation de l'électron sur l'orbite, ce qu'il justifie ultérieurement dans la section 3 de l'article que nous étudions en invoquant une version préliminaire du principe de correspondance :
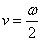 (3)
(3)
À partir des équations (1), (2) et (3), on peut déduire une série de valeurs indexées par le nombre entier n, concernant l'énergie, la fréquence de rotation et le diamètre de l'atome de l'hydrogène (E = e), valeurs qui sont en excellente concordance avec les valeurs expérimentales :
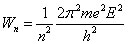
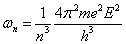
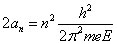 (4)
(4)
Bohr utilise les valeurs numériques connues à l'époque pour e et h, qui diffèrent d'environ 2% par rapport aux valeurs actuelles. Il trouve pour l'énergie du premier niveau (n = 1) la valeur 13 eV (la valeur actuelle est de 13,6 eV).
L'introduction de la constante de Planck induit dans la théorie quantique une longueur caractéristique
(13) ayant comme résultat
la "séparation" de W et a, donnés maintenant par deux formules distinctes (4) faisant intervenir h, alors que dans la théorie classique,
W et a étaient liés par la relation
(1).
Bohr mentionne l'article de Nicholson
(14), qui avait fait appel à la théorie de Planck pour proposer un modèle atomique semblable et expliquer le spectre de certains éléments chimiques présents dans les nébuleuses stellaires et dans la couronne solaire. Mais à la différence de Bohr, le modèle de Nicholson contient plusieurs électrons et traite des transitions entre les états excités de l'atome. Il identifie la fréquence du rayonnement émis avec celle de rotation des électrons, ce qui donne des résultats numériques qui diffèrent d'un facteur 2 par rapport à ceux de Bohr. Le modèle de Nicholson reste instable et le spectre émis ne respecte pas les formules empiriques de Balmer (voir l'encadré).
C'est pour pallier ces problèmes que Niels Bohr émet deux postulats audacieux :
[1] That the dynamical equilibrium of the systems in the stationary states can be discussed by help of the ordinary mechanics, while the passing of the systems between different stationary states cannot be treated on that basis.
[2] That the latter process is followed by the emission of a homogeneous radiation, for which the relation between the frequency and the amount of energy emitted is the one given by Planck's theory.
Le premier postulat affirme que l'électron se trouve sur l'orbite dans un état d'équilibre dynamique stationnaire ; dans un tel état, contrairement aux lois de l'électromagnétisme classique, l'électron n'émet pas de rayonnement, et ne peut donc pas tomber sur le noyau. Il affirme aussi que les changements entre états stationnaires ne peuvent, eux, être traités par la mécanique classique – ce que le deuxième postulat complète en indiquant que le changement d’état d’un électron s’accompagne d’un rayonnement dont la fréquence est donnée par la théorie de Planck.
@@@@@@@
C'est ce second postulat que Bohr utilise, dans la section 2 de cet article, pour déterminer les fréquences présentes dans le spectre de l'atome de l'hydrogène. À partir de la formule (4) appliquée au cas particulier de l'atome d'hydrogène (E = e), il calcule la différence d'énergie entre deux niveaux n1 et n2 et l'associe à l'énergie exprimée par la formule de Planck :
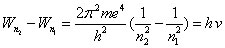 (5)
(5)
ce qui lui permet d'en déduire les fréquences du spectre :
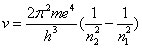 (6)
(6)
Dans le cas
n2 = 2, on obtient la formule de Balmer, en excellente concordance avec les données expérimentales : la différence entre les valeurs calculées et les valeurs expérimentales est inférieure à
6% et est due à l'imprécision des valeurs de
e, h et
e/m connues à l'époque
(15).
Les lignes spectrales de l'hydrogène
Une première explication du spectre de la lumière a été donnée par Isaac Newton au XVIIe siècle (16). À la fin du XVIIIe et au début du XIXe siècles, les connaissances avancent avec William Herschel, Johann Wilhelm Ritter, Thomas Young et Hermann Helmholtz. Mais c'est Gustav Kirchhoff et Robert Bunsen (17) qui posent les bases de la spectroscopie comme méthode d'analyse des substances chimiques, et à cette occasion découvrent le césium et le rubidium. La régularité des fréquences du spectre visible émis par l'hydrogène intrigue Johann Jakob Balmer, enseignant en mathématiques dans un lycée de Bâle qui en 1885 établit une formule empirique :
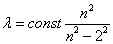

Figure 3 : Spectre Balmer de l'hydrogène. À partir d’une constante (K= 364,44 inverse de la constante de Rydberg), on trouve : 656 = 9/5K (n=3), 486 = 4/3K (n=4), 434 = 25/21K (n=5), 410 = 9/8K (n=6) (Wikipédia, auteurs Merikanto et Adrignola).
En 1888, Johannes Robert Rydberg tente d'expliquer le spectre des métaux alcalins et arrive à des relations mathématiques semblables. Le début du XXe siècle voit la découverte des lignes spectrales de l'hydrogène en ultraviolet par Theodore Lyman et en infrarouge par Friedrich Paschen, dont les longueurs d'onde obéissent à une généralisation simple de la formule de Balmer.
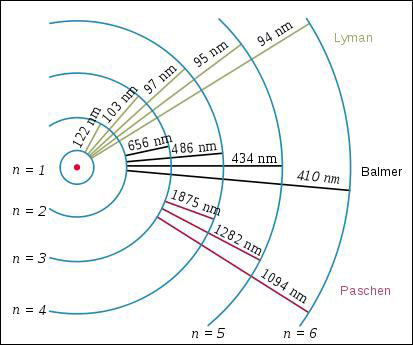
Figure 4 : Lignes spectrales Lyman, Balmer et Paschen de l'atome d'hydrogène. (WikiCommons, auteur Szdori)
La régularité est remarquable, la relation de Balmer se généralise sous la forme suivante, appelée formule de Rydberg :
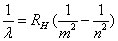 (7)
(7)
où RH = 109677,576 cm-1 est la constante de Rydberg. Pour m = 2, on obtient la série de Balmer, pour m = 1 celle de Lyman et pour m = 3 celle de Paschen (18). En fait, m et n sont deux niveaux d'énergie de l'atome. La transition du niveau n au niveau m est alors accompagnée par l'émission d'un rayonnement dont la fréquence est donnée par la relation de Planck, d'où la relation de Rydberg.
Bien que théoricien, Bohr dispose d'un bon sens expérimental lorsqu'il explique pourquoi on n'observe que douze lignes spectrales dans la série de Balmer lors des expériences effectuées en laboratoire avec des décharges dans les tubes à vide (qui contiennent en fait une faible pression d'hydrogène), alors que leur nombre atteint trente-trois dans les mesures spectrales des étoiles : à partir de n = 12, la taille des orbites atomiques devient comparable à la distance moyenne entre les molécules du gaz situé dans le tube à vide dont la pression n’est pas rigoureusement nulle, mais est de 9 mbar. Pour pouvoir visualiser des lignes supplémentaires, il faudrait augmenter la distance moyenne entre les molécules, donc baisser plus encore la pression, ce qui est réalisé dans la couronne des étoiles.
Bohr ne se contente pas d'étudier l'atome d'hydrogène mais applique son modèle à l'atome d'hélium (E = 2e), et ses prédictions concordent avec les valeurs du spectre de l'hélium mesuré dans les étoiles. En revanche, celui-ci n'est pas en concordance avec les résultats obtenus au laboratoire avec des tubes à vide. Il interprète correctement ce résultat : dans la couronne de l'étoile, l'hélium se trouve ionisé sous forme He+, il ne dispose donc que d'un seul électron (atome dit hydrogénoïde) et on peut donc lui appliquer ce modèle théorique. En revanche, dans le tube à vide, les énergies mises en jeu sont insuffisantes pour obtenir l'ionisation de l'hélium – celui-ci conserve ses deux électrons.
Par la suite, Bohr survole le cas des atomes à plusieurs électrons en rappelant la formule de Ritz, généralisation de la formule de Rydberg :
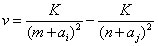
où ai et aj sont des constantes, m et n des entiers et K une constante universelle. Cependant Bohr n'entre pas dans les détails, il traitera dans la partie II de la "Trilogie" le cas du lithium et du béryllium, ainsi que d'autres atomes à plusieurs électrons. Les spectres de ces derniers sont assez compliqués et ne peuvent être expliqués de manière satisfaisante que dans le cadre du formalisme de la mécanique quantique. Bohr se contente alors de montrer l'universalité de la constante K : lorsque l'orbite d'un électron est très élevée, l'atome devient hydrogénoïde et on peut lui appliquer la formule de Rydberg : la constante universelle K n'est alors autre que la constante de Rydberg.
@@@@@@@
Dans la troisième section de l'article, Bohr revient sur la justification de la relation (3) et utilise de façon ingénieuse une version préliminaire du principe de correspondance, qu'il énoncera dans une version plus complète en 1923 : quand les nombres quantiques d'un système deviennent très grands, le système se comporte en accord avec les lois de la physique classique.
Il reconsidère une version plus générale de la relation (2) et montre que pour respecter la relation de Balmer, l'énergie émise par rayonnement lorsque l'électron passe de l'infini à l'orbite d'énergie –W est de la forme :
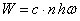
où c est une constante à déterminer.
Bohr refait alors la chaîne de raisonnement de la section 2 de l'article pour trouver la fréquence du rayonnement émis lorsque l'atome effectue une transition de l'état N à l'état N-1 :
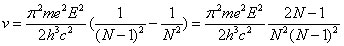
et la fréquence de rotation de l'électron sur l'orbite N :
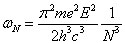
Si le nombre
N est très grand, conformément à la physique classique, on s'attend, conformément au principe de correspondance, que la fréquence du rayonnement émis soit égale à celle de la révolution de l'électron sur l'orbite
N (19).
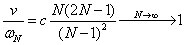
d'où c = ½.
Bohr considère ensuite une transition entre les niveaux N et N-n avec N très grand par rapport à n et par le même type de raisonnement, il montre que la fréquence du rayonnement émis est égale à ν = n ω, où ω est la fréquence de révolution de l'électron. Il ajoute :
The possibility of an emission of a radiation of such a frequency may also be interpreted from analogy with the ordinary electrodynamics, as in electron rotating round a nucleus in an elliptical orbit will emit a radiation which according to Fourier's theorem can be resolved into homogeneous components, the frequencies of which are nω, if ω is the frequency of revolution of the electron. We are led to assume that the interpretation of the equation (2) is not that the different stationary states correspond to an emission of different numbers of energy-quanta, but that the frequency of the energy emitted during the passing of the system from a state in which no energy is yet radiated out to one of the different stationary states, is equal to different multiples of ω/2 where ω is the frequency of revolution of the electron in the state considered.
Il n'est donc plus question de l'hypothèse initiale de Planck où Bohr admettait l'émission de n quanta de fréquence ω, mais de l'émission d'un seul quanta de fréquence nω !
Bohr conclut la troisième section en calculant le moment cinétique d'un électron en mouvement circulaire
L = m (2π ω) a2, et en utilisant les valeurs de
ω et
a données
(20) par l'équation
(4), il trouve :
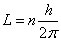
the angular momentum of the electron round the nucleus in a stationary state of the system is equal to an entire multiple of a universal value, independent of the charge on the nucleus (21).
@@@@@@@
Dans la quatrième section, Bohr traite l'absorption de la radiation. Conformément à la loi de Kirchhoff, il doit y avoir une symétrie entre l'émission et l'absorption du rayonnement :
[…] a system consisting of a nucleus and in electron rotating round it under certain circumstances can absorb a radiation of a frequency equal to the frequency of the homogeneous radiation emitted during the passing of the system between different stationary states.
L'absorption peut être mise en évidence dans des expériences avec des tubes à vide à hydrogène, à condition que ce dernier se trouve dans un état "lumineux" : les décharges électriques brisent les liaisons chimiques de certaines molécules d'hydrogène H2 et le tube contient alors également de l'hydrogène à l'état atomique H, qui absorbe alors le rayonnement de même fréquence que celui du spectre d'émission, traité dans les sections précédentes de l'article.
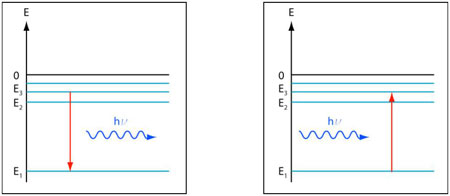
Figure 5 : Émission et absorption du rayonnement. À gauche, un atome excité dans l'état n=3 effectue une transition quantique vers l'état fondamental n=1 et émet un photon d'énergie hν=E3-E1. À droite, l'atome, situé initialement dans l'état fondamental n=1 absorbe un photon d'énergie hν=E3-E1 et effectue une transition vers l'état excité n=3. (© Ilarion Pavel)
Bohr considère les deux cas de l'absorption, suivant que l'énergie du rayonnement est inférieure ou supérieure à celle de la valeur absolue du niveau fondamental de l'atome (le niveau d'énergie le plus bas, correspondant à n = 1). Dans le premier cas, seules sont permises les transitions discrètes entre le niveau fondamental de l'atome et un de ses niveaux excités. En revanche, le deuxième cas peut avoir lieu pour toute valeur de l'énergie car l'atome se ionise et l'électron devient libre. Bohr relie ce phénomène à l'effet photoélectrique :
[…] the same expression for the kinetic energy of an electron ejected from an atom by photo-electric effect as that deduced by Einstein, i. e. T = hν - W, where T is the kinetic energy of the electron ejected, and W the total amount of energy emitted during the original binding of the electron.
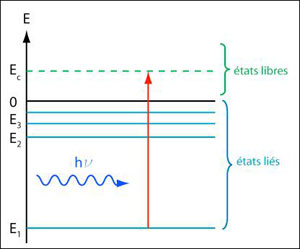
Figure 6 : Ionisation de l'atome. L'énergie du rayonnement hν est supérieure à la valeur absolue de l'énergie fondamentale |E1|. L'électron est alors éjecté de l'atome avec une énergie cinétique Ec= hν -|E1|. Contrairement aux états liés, qui sont discrets, les états libres sont continus. (© Ilarion Pavel)
Bohr utilise ces concepts théoriques pour expliquer le spectre d'absorption des vapeurs de sodium, mis en évidence par Robert Williams Wood, qui comporte des lignes discrètes mais également une bande continue :
[…] In these experiments, an absorption corresponding to a very great number of lines in the principal series of the sodium spectrum is observed, and in addition a continuous absorption which begins at the head of the series and extends to the extreme ultra-violet.
Selon Bohr, le phénomène de diffusion du rayonnement par l'atome est un argument supplémentaire en faveur de l'existence de l'absorption. La diffusion a lieu si l'énergie du rayonnement est égale à la différence entre un niveau d'énergie discret et l'état fondamental de l'atome mais aussi si son énergie est supérieure à la valeur absolue de l'état fondamental. Dans les deux cas, l'absorption est immédiatement accompagnée par l'émission du rayonnement, l'atome se trouvant ainsi dans un état excité transitoire de courte durée.
À la fin de cette section, Bohr interprète l'émission des rayons X (en spectre discret) comme étant réalisé par des électrons situés sur des couches d’énergie supérieure qui effectueraient des transitions quantiques vers des états d'énergie inférieure. Ces derniers sont disponibles car leurs électrons ont été éjectés à la suite d’un bombardement avec des électrons émis à la cathode et accélérés par l'anode.
[…] In analogy to the assumption used in this paper that the emission of line-spectra is due to the re-formation of atoms after one or more of the lightly bound electrons are removed, we may assume that the homogeneous Roentgen radiation is emitted during the setting down of the systems after one of the firmly bound electrons escapes, e.g. by impact of cathode particles.
Enfin, Bohr apporte comme argument supplémentaire à sa théorie les résultats de l'interaction d'un flux de particules bêta (électrons) émis par certaines substances radioactives avec la matière, étudiés par Rutherford :
[…] an electron of great velocity in passing through an atom and colliding with the electrons bound will loose energy in distinct finite quanta. As is immediately seen, this is very different from what we might expect if the result of the collisions was governed by the usual mechanical laws. The failure of the classical mechanics in such a problem might also be expected beforehand from the absence of anything like equipartition of kinetic energy between free electrons and electrons bound in atoms.
Il conclut sur la nécessité d'une théorie quantique pour expliquer ces faits expérimentaux :
The preliminary and hypothetical character of the above considerations needs not to be emphasized. The intention, however, has been to show that the sketched generalization of the theory of the stationary states possibly may afford a simple basis of representing a number of experimental facts which cannot be explained by help of the ordinary electrodynamics, and that assumptions used do not seem to be inconsistent with experiments on phenomena for which a satisfactory explanation has been given by the classical dynamics and the wave theory of light.
@@@@@@@
Dans la cinquième et dernière section de l'article, Bohr se lance dans des considérations plus calculatoires sur les états stationnaires de l'atome à plusieurs électrons. Il considère, comme dans le modèle de Thomson,
N électrons
(22) qui tournent autour du noyau atomique sur une orbite circulaire sur laquelle ils sont régulièrement repartis. L'énergie potentielle d'un tel système est donnée par l'énergie d'interaction entre les électrons et le noyau, à laquelle on ajoute l'énergie d'interaction entre les électrons :
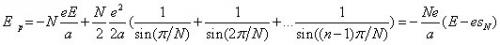
où
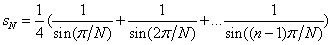
On peut utiliser le théorème du viriel (voir l'appendice mathématique) pour simplifier le calcul de Bohr. L'énergie totale et l'énergie cinétique du système sont données par la relation :
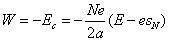
L'expression de l'énergie cinétique permet de calculer la fréquence de rotation :
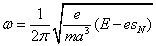
En comparant ces deux dernières relations mathématiques avec les formules (1), on en déduit que le système se comporte de la même manière que celui considéré dans la première section de l'article de Bohr (un seul électron qui orbite autour du noyau). Il suffirait d'effectuer les substitutions formelles :
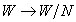
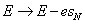
Bohr répète alors le même raisonnement que celui de la première section de l'article (l'énergie du système est en valeur absolue égale à la moitié de l'énergie donnée par la formule de Planck) pour déduire les états stationnaires du système, son état fondamental, ainsi que la quantification du moment cinétique. Il fait appel aux données expérimentales sur les lignes spectrales pour soutenir l'hypothèse que l'état fondamental est celui où les électrons tournent autour du noyau atomique sur une orbite circulaire sur laquelle ils sont régulièrement repartis – mais ses arguments sont moins convaincants.
Bohr critique la théorie atomique de Nicholson. Ce dernier traite l'atome sur des bases de mécanique classique : l'atome ne peut donc pas être stable. Selon Nicholson, le rayonnement émis par l'atome est dû aux vibrations des électrons autour de leur position d'équilibre, situés sur l'orbite circulaire autour du noyau et non aux transitions quantiques entre des états stationnaires, comme Bohr le propose dans cet article.
À la fin ce cette section, Bohr utilise le théorème du viriel, qui lui permet de généraliser son raisonnement et d’étendre ses conclusions aux atomes dont les électrons se trouvent sur une orbite elliptique :
In analogy with the case of a single ring we are here led to assume that corresponding to any configuration of equilibrium a series of geometrically similar, stationary configuration of the system will exist in which the kinetic energy of every electron is equal to the frequency of revolution multiplied by τ/2h where τ is an entire number and h Planck's constant. In any such series of stationary configurations the one corresponding to the greatest amount of energy emitted will be the one in which τ for every electron is equal to 1. In any molecular system consisting of positive nuclei and electrons in which the nuclei are at rest relative to each other and the electrons more in circular orbits, the angular momentum of every electron round the centre of its orbit will in the permanent state of the system be equal to h/2π, where h is Planck's constant.
Il est étonnant que Bohr attende la fin de l'article pour rappeler le théorème du viriel, qui lui aurait permis de simplifier considérablement les calculs mathématiques présentés au long de son article. Cette dernière section a probablement été rajoutée ultérieurement
(23).
Conséquences du modèle atomique de Bohr
Planck a introduit l'hypothèse des quanta et de la constante qui porte son nom pour expliquer que l'échange d'énergie entre le rayonnement et la matière ne peut avoir lieu que via des quantités discrètes, les quanta. Einstein va plus loin en proposant que la structure même du rayonnement est discrète et que la lumière est constituée des "corpuscules", qui seront plus tard appelés photons. Bohr applique l'hypothèse des quanta pour traiter un système dynamique, l'atome d'hydrogène.
Le modèle de Bohr connaît un grand succès car il explique le spectre de l'hydrogène et de l'ion de l'hélium. En 1914, les mesures d’Henry Moseley sur certaines lignes du spectre des rayons X seront en accord avec ce modèle. La même année, James Franck et Gustav Hertz font collisionner des électrons avec des atomes de mercure dans un tube à vide et observent que les électrons perdent de l'énergie par quanta, et que les atomes de mercure émettent du rayonnement ultraviolet dont la fréquence est celle calculée par la théorie de Bohr.
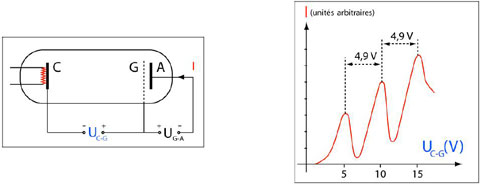
Figure 7 : L'expérience Franck et Hertz. Les électrons émis par la cathode C chauffée par le filament sont accélérés par la tension cathode grille UC-G, et sont susceptibles d’interagir avec les atomes de mercure présents dans le tube. Ils passent à travers la grille G, puis sont légèrement décélérés par la tension grille anode UG-A. Ceux qui ont une énergie suffisante arrivent sur l'anode A et donnent naissance au courant I, dont la valeur devrait augmenter avec la tension accélératrice. Pourtant, dès que cette dernière atteint des valeurs multiples de 4,9 V, on mesure des baisses significatives du courant : par des collisions inélastiques, les électrons transfèrent une partie de leur l'énergie aux atomes de mercure, qui passent dans le premier état excité, puis reviennent à l'état fondamental en émettant du rayonnement ultraviolet dont la fréquence est en accord avec la théorie de Bohr. (© Ilarion Pavel)
Malgré ses succès expérimentaux, le modèle de Bohr soulève de nombreuses questions. Pourquoi les états sont-ils discrets ? Pourquoi certaines fréquences ne sont-elles jamais observées dans le spectre d'un élément chimique, i.e. pourquoi certaines transitions entre deux états stationnaires n'ont-elles jamais lieu ? Pourquoi certaines lignes spectrales sont-elles plus intenses que d'autres ? Bohr lui-même était conscient des limites de son modèle et il concentra ses efforts sur la compréhension de la structure des atomes à plusieurs électrons, en relation avec la classification périodique de Mendeleïev.
@@@@@@@
En novembre 1913, Johannes Stark découvre que les lignes spectrales de l'hydrogène se multiplient quand l'atome est placé dans un champ électrique (effet Stark), effet qui ne peut pas être expliqué par le modèle de Bohr.
Un an plus tard, des mesures plus précises montrent que, même en l'absence de champ électrique, une ligne spectrale de l'hydrogène est en effet double ; elle a donc une structure fine
(24) et la relation de Balmer n'est pas tout à fait exacte. Bohr spécule que cette structure fine provient du fait que les orbites sont elliptiques et qu'on devrait prendre en compte des corrections relativistes pour le mouvement de l'électron
(25).
En 1916, inspiré par ces idées, Arnold Sommerfeld améliore le modèle atomique de Bohr, explique la structure fine des lignes spectrales
(26) et introduit le nombre quantique orbital
l et le nombre quantique magnétique
m. Paul Epstein et Karl Schwarzschild expliquent l'effet Stark, et Hendrik Kramers calcule les intensités de lignes spectrales du même effet. Einstein utilise la théorie de Bohr pour déduire la loi de Planck du rayonnement du corps noir et découvre à cette occasion l'émission stimulée, qui est à la base du fonctionnement des lasers.
Entre 1918 et 1922, Bohr mène un travail acharné pour comprendre le spectre des atomes. Il énonce les règles de sélection, non pas à partir d'une théorie mathématique mais en s'inspirant des données expérimentales spectroscopiques et chimiques. Il a fallu remplacer assez rapidement le concept initial d'orbite circulaire de l'électron par celui de couche sphérique, pour expliquer la stabilité des gaz rares du tableau périodique de Mendeleïev. L'étude de ce dernier a conduit Bohr à postuler l'existence d'un nouvel élément chimique de nombre atomique Z=72, appelé hafnium, découvert par des chimistes quelques mois plus tard. Ces travaux constituent le point de départ d'une nouvelle discipline : la chimique quantique.
@@@@@@@
Cependant deux questions restaient à résoudre : l'effet Zeeman anormal et l'atome d'hélium.
Découvert par Pieter Zeeman, l'effet Zeeman était connu depuis 1897 : une ligne spectrale d'une source de lumière soumise à un champ magnétique se clive en plusieurs lignes rapprochées, chacune ayant une certaine polarisation. Ce phénomène s'explique par l'interaction du champ magnétique avec le moment magnétique orbital de l'électron (quantifié par le nombre quantique magnétique m), produisant ainsi un levé de dégénérescence des 2l+1 états d'un niveau énergétique donné (voir l'appendice mathématique). Ces observations étaient valables pour un champ magnétique fort. En revanche pour un champ magnétique faible, les résultats étaient incompréhensibles (en particulier le nombre de lignes clivées était pair), c'est d'ailleurs pourquoi on l'appela l'effet Zeeman anormal.
Bien que le modèle de Bohr explique avec succès l'ion d'hélium, qui n'est qu'un atome hydrogénoïde (à un seul électron), il échoue complètement pour l'atome d'hélium, qui dispose de deux électrons. Le spectre montrait l'existence d'un singulet et d'un doublet (des mesures plus précises ont montré ultérieurement qu'il s'agit en effet d'un triplet).
Ces deux questions ne trouveront une réponse qu'avec l'introduction du concept de spin.
En 1924, l'étude de l'effet Zeeman anormal conduit Wolfgang Pauli à introduire un quatrième nombre quantique s (appelé plus tard nombre quantique de spin), qui ne prend que deux valeurs, ainsi que le principe d'exclusion qui porte son nom : dans un atome, deux électrons ne peuvent pas occuper le même état, c'est-à-dire ne peuvent pas avoir les mêmes nombres quantiques n, l, m et s. Il parvient ainsi à expliquer les nombres magiques 2, 8, 18 qui caractérisent les couches complètes du tableau périodique des éléments.
En 1925, Georg Uhlenbeck et Samuel Goudsmith proposent l'hypothèse que les électrons sont pourvus de spin, sorte de mouvement de rotation autour de leur axe, et disposent donc d'un moment magnétique, comme l'aiguille d'une boussole. La projection du spin sur un axe ne prend pas de valeurs continues mais seulement deux valeurs qui sont multiples de la constante de Planck : +½ (spin up) et -½ (spin down). La connexion avec le nombre quantique s de Pauli est alors établie.
En effet, déjà en 1922 Otto Stern et Walter Gerlach avaient fait défléchir des atomes d'argent par un champ magnétique inhomogène en les projetant sur un écran. D'un point de vue classique, l'orientation du moment magnétique de l'atome pouvant prendre n'importe quelle direction ; on s'attendait à voir une grande tâche continue sur l'écran et à la surprise générale on n'observa que deux petites tâches symétriques : le moment magnétique ne prenait que deux valeurs. Mais ce n'est qu'en 1927 que cette expérience sera finalement comprise.
Si on prend en compte le spin, l'effet Zeeman anormal est résolu : le moment cinétique orbital se compose avec celui de spin pour donner le moment cinétique total. C'est ce dernier qui interagit avec le champ magnétique faible. Un champ magnétique fort détruit ce couplage et il interagit séparément avec le moment cinétique orbital et avec le moment cinétique de spin : c'est l'effet Zeeman normal.
L'explication du spectre de l'hélium devra attendre 1927, quand Werner Heisenberg utilisera le concept de spin, le principe d'exclusion de Pauli ainsi que le formalisme mathématique de la mécanique quantique récemment découvert. C'est la composition des spins ½ de deux électrons de l'atome d'hélium qui conduisent à un état de spin 0 (singulet) et à trois états de spin 1 (triplet).
De fait, ces efforts successifs de compréhension de la structure de l'atome, dont Bohr est le pionnier, aboutiront en 1925 au développement de la mécanique matricielle par Werner Heisenberg. Parallèlement, inspiré par les travaux de Louis de Broglie, Erwin Schrödinger développe en 1926 la mécanique ondulatoire. La même année, Paul Adrien Maurice Dirac montre que les deux formalismes sont équivalents : le formalisme de la mécanique quantique était né. Il reste encore valable aujourd’hui, aucune expérience ne l'ayant pris en défaut.
Autres travaux de Niels Bohr
n 1923, Niels Bohr affine le principe de correspondance : si on applique la mécanique quantique à des objets macroscopiques, il existe une limite, appelée "limite classique", où les lois quantiques se réduisent à des lois classiques.
Lorsqu'on décrit le comportement des atomes ou des particules élémentaires, on fait appel aux lois de la mécanique quantique, lorsqu'on décrit le mouvement d'une pendule ou d'une automobile, on utilise les lois de la mécanique classique. En effet, les lois de la nature sont quantiques, les lois classiques ne sont qu'une approximation de ces premières, d'autant meilleure que le système étudié est grand.
Bien évidemment, on pourrait utiliser les lois quantiques pour déterminer la trajectoire d'une automobile, mais cela serait compliqué et laborieux. On préfère plutôt travailler dans le cadre des lois classiques, plus approximatif mais beaucoup mieux adapté et plus facile à appliquer.
Le principe de correspondance reste d'actualité et se généralise pour toute théorie physique. Nous ne connaissons pas la théorie ultime de la nature et nous décrivons donc la réalité avec un certain degré d'approximation et dans un certain domaine de validité. Avec l'évolution des connaissances, une nouvelle théorie remplace l'ancienne, son domaine de validité s'élargit. Mais si on se place dans le cadre de cette nouvelle théorie et si on restreint intentionnellement son domaine de validité aux limites initiales, on doit retrouver l'ancienne théorie comme cas limite.
Les théories physiques s'emboîtent donc comme des poupées russes : la mécanique newtonienne est inclue dans la relativité restreinte, la gravitation newtonienne dans la relativité généralisée, la théorie de Fermi de l'interaction faible et l'électrodynamique quantique dans le modèle électrofaible Weinberg-Salam, l'interaction forte de type Yukawa dans la chromodynamique quantique. À leur tour, le modèle électrofaible et la chromodynamique sont contenus dans le Modèle Standard des particules, qui pourrait être un cas particulier des Grandes Théories d'Unification (GUT). Enfin, la relativité généralisée et le GUT pourraient faire partie d'une théorie plus complète, dite de supergravité, qui à son tour, serait partie d'une théorie des supercordes.
@@@@@@@
En 1927, Heisenberg découvre les relations d'incertitude qui portent son nom : on ne peut pas déterminer en même temps avec précision la position et la quantité de mouvement d'une particule quantique. Ce résultat exerce une forte influence sur Bohr, qui énonce par la suite le principe de complémentarité
(27).
On peut réaliser par exemple une expérience d'interférence avec des photons qui passent à travers deux fentes de Young et qui sont détectés sur un écran à l'aide d'une cellule photoélectrique. Sur l'écran, on constate l'apparition des franges lumineuses, manifestations du comportement ondulatoire (passage des photons par les fentes d'Young), alors que le processus de détection exhibe le comportement corpusculaire (activation du détecteur par effet photoélectrique). Les photons ont donc une nature duale : ils présentent à la fois un comportement ondulatoire et corpusculaire. Mais dans une expérience donnée, on ne peut mettre en évidence qu'un seul de ces deux comportements.
Lorsqu'on effectue une mesure sur des objets qui obéissent aux lois quantiques, le résultat dépend intrinsèquement du dispositif de mesure utilisé et est exprimé en termes classiques. Il est impossible de séparer l'objet mesuré de l'instrument de mesure. Une description complète d'un phénomène ne peut être réalisée qu'avec des mesures effectuées par plusieurs dispositifs complémentaires.
Toujours en 1927, lors du congrès Solvay, Niels Bohr mène de passionnants débats avec Albert Einstein au sujet du déterminisme statique de la mécanique quantique, qu’Einstein n'a jamais accepté.
@@@@@@@
Après l'expérience de Rutherford, la physique nucléaire connaît relativement peu d'avancées et à la fin des années 1920, elle traverse une grave crise. On pensait que le noyau atomique était composé de
A protons, qui donnent en grande partie sa masse, et de
A-Z électrons, afin de compenser la charge électrique excédentaire apportée par ces protons
(28). Selon ce modèle, le noyau de l'azote devait comporter
14 protons et
7 électrons, donc
21 particules de spin ½, et donc avoir un spin total demi-entier. Or les expériences montraient que son spin était entier. La solution apparaît en 1932, quand James Chadwick découvre le neutron, particule de masse pratiquement égale à celle du proton mais de charge nulle : le noyau est en fait composé de
Z protons et de
A-Z neutrons, le noyau de l'azote disposant de
7 protons et
7 neutrons, dont le spin total est entier, en accord avec l'expérience
(29).
En 1936, Bohr propose le modèle dit "de la goutte liquide"
(30) afin d'expliquer la structure du noyau et les réactions nucléaires : le noyau atomique n'est pas rigide, les neutrons et les protons qui le composent se comportent de manière analogue à un liquide. Une réaction nucléaire se déroule alors en deux étapes. La particule projectile est d'abord capturée par le noyau (qui devient un noyau composite) et son énergie est redistribuée parmi ses constituants. Ensuite, grâce à des fluctuations statistiques, cette énergie excédentaire se concentre sur certains constituants du noyau composite, le fait éclater et le transforme finalement en produits de réaction. Ce modèle connaît un grand succès : en 1938, il explique la fission nucléaire, qui sera l'élément clé du projet Manhattan de construction de la bombe atomique et du fonctionnement des réacteurs nucléaires.

Figure 8 : Pièce de 20 kroner (couronnes) émise par la Banque du Danemark à l’occasion du centenaire des articles de Bohr (2013).
Conclusion
Niels Bohr est un des plus brillants physiciens du XXe siècle, doué d'un sens physique profond et d'une intuition hors du commun. Bien qu'il maîtrisait le calcul mathématique, ses articles sont plus conceptuels que calculatoires. Il accordait une grande importance aux raisonnements physiques.
Son modèle atomique fut le point de départ de nombreux travaux qui culminent avec la mise au point du formalisme mathématique de la mécanique quantique. Le principe de correspondance établit la relation entre la physique classique et la physique quantique, le principe de complémentarité jette une nouvelle lumière sur la nature de l'interaction entre l'appareil de mesure et l'objet observé, et a de profondes conséquences philosophiques, dont certaines restent d'actualité. Ses travaux en physique nucléaire ont ouvert la voie à la compréhension de la fission nucléaire.
Bohr n'est seulement un scientifique d'exception mais aussi un administrateur hors pair. Avec un sens remarquable des relations publiques, il a su trouver les financements pour fonder l'Institut de Physique Théorique de Copenhague et accorder ainsi des bourses d'étude à une pléiade de jeunes scientifiques, dont une dizaine seront lauréats du prix Nobel.
Bohr est également un scientifique engagé. Pendant les persécutions nazies, il accorde protection à des scientifiques ayant quitté l'Allemagne ou l'Autriche. Il participe au projet "Manhattan" de construction de la bombe atomique, puis pendant la guerre froide, milite pour le partage des informations scientifiques et techniques sur les armes nucléaires comme garantie de la stabilité politique.
Niels Bohr joue un rôle important dans la création en 1954 du CERN (le laboratoire européen pour la physique des particules) et fonde en 1957 l'Institut Nordique de Physique Théorique (NORDITA).
Le 107e élément du tableau périodique des éléments, découvert en 1981, sera nommé Bohrium en son honneur.
Théorème du viriel
On considère le mouvement d'un électron autour d'un noyau fixe. La force d'interaction entre ces deux particules est directement proportionnelle aux charges (dont le produit est noté par la constante positive k) et inversement proportionnelle au carré de la distance :
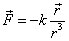
et provient de l'énergie potentielle :
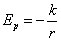
La variation dans le temps du produit scalaire entre la quantité de mouvement
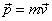
et le vecteur de position
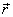
de l'électron :
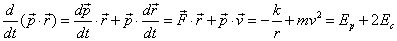 (1)
(1)
où
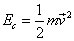
est l'énergie cinétique de l'électron.
La valeur moyenne dans le temps de l'équation (1) est (la barre au-dessus des quantités E indique leur moyenne dans le temps) :
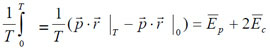
Pour un temps T très long, pour des vitesses finies et une trajectoire bornée, le membre de gauche s'annule, ce qui donne le théorème du viriel : l'énergie cinétique moyenne représente la moitié de l'énergie potentielle moyenne (en valeur absolue) :
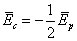
Alors l'énergie totale, qui est constante, s'écrit :
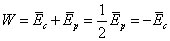
Ce théorème se généralise pour toute énergie potentielle fonction homogène du vecteur de position,
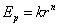
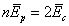
En effet les coefficients qui multiplient les valeurs moyennes des deux énergies sont les indices d'homogénéité. Dans ce cas, l'énergie potentielle est fonction homogène de degré n en r, l'énergie cinétique est fonction homogène de degré 2 en v.
Problème de Kepler
On considère, comme dans la section précédente, le mouvement d'un électron autour d'un noyau fixe, dont la position est
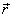
et la quantité de mouvement
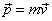
. La variation du moment cinétique
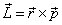
est égale au moment de la force (théorème du moment cinétique):
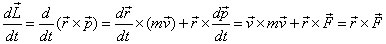
Dans la cadre d'une force centrale (orientée suivant la direction du vecteur de position
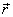
), le moment de la force s'annule, donc le vecteur moment cinétique est constant, en direction et en module (conservation du moment cinétique). En conséquence, le plan formé par le vecteur de position et la quantité de mouvement est fixe, donc l'orbite de l'électron est plane.
On peut alors choisir les coordonnées polaire
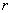
et
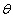
pour caractériser le mouvement :
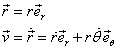
Le moment cinétique :
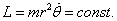 (2)
(2)
et l'énergie totale :
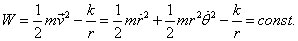 (3)
(3)
sont constants (intégrales premières du mouvement) comme conséquences des lois de conservation du moment cinétique et de l'énergie.
À partir de l'équation
(2), on peut éliminer la variable
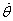
dans l'équation
(3):
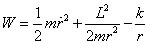 (4)
(4)
Le deuxième terme représente l'énergie cinétique centrifuge (L est constant et le terme est en 1/r²), qui empêche l'électron de s'approcher du noyau, et la somme des deux derniers termes est l'énergie potentielle effective.
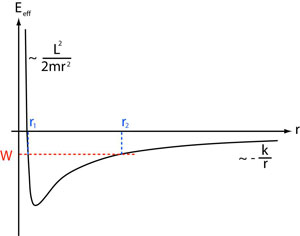
Figure 9 : Énergie potentielle effective. Si l’énergie totale W est négative (pointillés rouges), la courbe de l’énergie potentielle effective (toujours inférieure à W d’après (4)) reste sous les pointillés rouges, et la trajectoire est bornée (© Ilarion Pavel)
D'après la courbe ci-dessus : si l'énergie totale W est négative, la trajectoire est bornée, plus exactement le vecteur de position de l'électron est compris entre r1 et r2 – ce seront les valeurs du demi petit axe et du demi grand axe de l’ellipse que l’on obtient ci-après.
On exprime
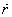
et
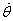
en utilisant les équations
(4) et
(2) respectivement.
Alors
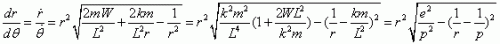
où
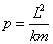
et
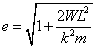
sont constantes.
L'intégration de cette équation différentielle donne :
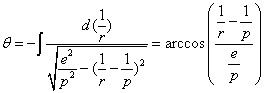
soit
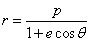
qui est l'équation d'une ellipse d'excentricité e et de paramètre p.
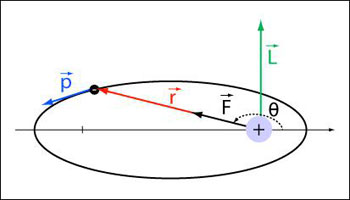
Figure 10 : La solution du problème de Kepler : la trajectoire est une ellipse (© Ilarion Pavel)
Les rayons maximal et minimal s'obtiennent pour l'angle égal à 0 et π respectivement, ce qui donne :
, soit
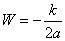
Si l’on substitue
k= eE (produit des charges électriques de l'électron et du noyau
(31)) et l’on remplace l'énergie totale par l'énergie cinétique (égale au module mais de signe changé, conformément au théorème du viriel), on retrouve la deuxième relation utilisée par Bohr dans son article, soit :
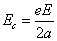
Pour trouver la première relation utilisée par Bohr dans son article, il faut intégrer l'équation (2), ce qui donne sur la période 0-2π :
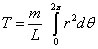
c'est-à-dire, en utilisant l'équation (5) :
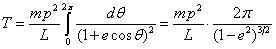
qui s'intègre par un calcul direct avec une substitution
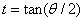
, et en remplaçant les expressions du paramètre
p et de l'excentricité
e :
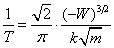
Les dimensions des atomes
L'introduction de la constante de Planck implique l'apparition dans la théorie d'une longueur spécifique. En effet, à partir de la constante de Planck, de la vitesse de la lumière et de la masse d'une particule, on peut définir une longueur spécifique, appelée pour des raisons historiques longueur d'onde de Compton
(32) :
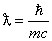
Dans une perspective plus moderne, conformément aux relations d'incertitude d’Heisenberg, une particule confinée dans un espace restreint de dimension
d, aura une quantité de mouvement de l'ordre
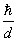
, donc son énergie sera de l'ordre
(33) :
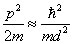
On rétrécit alors la dimension d de manière à ce que cette énergie devienne comparable avec l'énergie de repos de la particule :
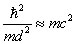
Cela se produit quand la dimension linéaire d est de l'ordre de grandeur de la longueur d'onde de Compton. Conformément à la relativité restreinte, à cet ordre de grandeur de l'énergie, commencent à apparaître des paires particule-antiparticule.
Si la particule est chargée électriquement, on peut introduite une constante adimensionnelle, dite de structure fine
(34), qui exprime le rapport entre l'énergie de l'interaction électrique entre deux telles particules situées à une distance égale à leur longueur d'onde de Compton, et l'énergie de repos
(35):
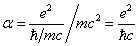
Elle représente la mesure de l'intensité de l'interaction électromagnétique et sa valeur numérique est d'environ 1/137.
Si on considère maintenant un électron et un proton (atome d’hydrogène) situés à une distance égale à la longueur d'onde de Compton, leur énergie électromagnétique d'interaction est environ 137 fois plus faible que l'énergie cinétique due au confinement quantique (égale à l’énergie de repos de l’électron). Ce système n'est pas stable et on s'attend alors qu'il évolue : la distance entre les deux particules augmente, de sorte que l'énergie due au confinement quantique ait le même ordre de grandeur que l'énergie d'interaction électromagnétique. La première quantité varie inversement avec le carré de la distance, la deuxième avec le simple. On s'attend alors à ce qu’un équilibre se produise pour une distance d'environ 137 fois plus grande que la longueur d'onde de Compton de l'électron, soit :
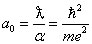
qui est bien le rayon de la première orbite de l'atome de Bohr (voir formule (4) ci-dessus, avec n = 1 et e = E). On remarque que la vitesse de la lumière a disparu, ce qui est cohérent avec le fait que l'atome de Bohr est non-relativiste.
L'énergie de l'atome dans son état fondamental est alors :
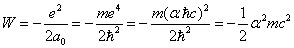
Le terme 1/2 est donné par le théorème du viriel, une première puissance en alpha vient du fait qu'à une distance de l'ordre de la longueur d'onde de Compton, l'énergie électromagnétique est alpha fois l'énergie du repos. Mais l'électron se trouve à une distance d'un rayon de Bohr par rapport au proton, qui est 1/alpha fois la longueur d'onde de Compton. Comme l'énergie électromagnétique est inversement proportionnelle à la distance, cela conduit à une deuxième puissance en alpha.
Le rapport entre la longueur d'onde λ d'un photon émis dans une transition quantique entre deux niveaux de l'atome et la taille du même atome est (en ordre de grandeur) :
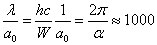
La longueur d'onde du photon est donc 1 000 plus grande que la taille de l'atome, cette différence est expliquée par la faible valeur de la constante de structure fine α (1/137).
L'énergie d'un électron classique qui tourne sur une orbite autour d'un noyau est donnée par :
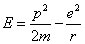
À ce stade de la théorie, il n'existe pas de dimension spécifique dans le système et l'orbite est une ellipse dont la valeur du grand demi-axe s'exprime en fonction de l'énergie. Cependant, si on introduit la constante de Planck via les relations d'incertitude d’Heisenberg, la quantité de mouvement et le rayon de l'orbite sont liés :
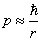
et l'énergie du système s'écrit :
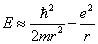
L'état fondamental (dont l'énergie est minimale) se détermine en minimisant
E en fonction du rayon
r, ce qui conduit à
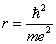
, qui est le premier rayon de Bohr. Le facteur numérique est exact, mais il ne s'agit bien sûr que d'une coïncidente fortuite. L'importance du résultat réside dans son ordre de grandeur.
L'atome d'hydrogène
Le traitement de l'atome d'hydrogène par le formalisme de la mécanique quantique (non relativiste) conduit aux résultats suivants.
Les états d'énergie sont discrets et donnés par la même formule de Bohr, où apparaît le nombre quantique principal n ; chaque état est fortement dégénéré : - il contient n états différents exprimés par le nombre quantique orbital l = 0, 1, …, n-1, qui donne la forme du nuage électronique (orbital) ; - chaque orbital de type l contient 2l+1 sous-états, décrits par le nombre quantique magnétique m = -l, -l+1, …, -1,0, 1, …l-1, l. - un électron a un nombre quantique de spin s, qui peut prendre deux valeurs : 1/2 et -1/2.
Un état d'énergie n contient alors un nombre d'états dégénérés :
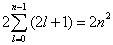
ce qui explique les nombres « magiques » 2, 8, 18, … (n = 1, 2, 3, …) des couches complètes dans le tableau périodique des éléments.
Lorsqu'on prend en considération les effets relativistes, la dégénérescence en l et s est levée, ce qui explique ainsi la structure fine de l'atome de l'hydrogène.
Le champ magnétique lève la dégénérescence en m et s, et explique l'effet Zeeman.
Décembre 2013

(1) Par système suffisamment grand on comprend un système dont l'action (produit entre l'énergie et le temps, ou équivalent, entre position et quantité de mouvement) est bien plus grande que la constante de Planck h.
(2) Lord Kelvin, Nineteenth Century Clouds Over the Dynamical Theory of Heat and Light, The London, Edinburgh and Dublin Philosophical Magazine and Journal of Science Series 6, 2, p. 1, (1901).
(3) J. J. Thomson, Philosophical Magazine Series 6, vol. 7, no. 39, p. 237, (1904).
(4) H. Geiger, E. Marsden, Proceedings of the Royal Society Series A 82, p. 495, (1909).
(5) Rutherford, Philosophical Magazine Series 6, vol. 21, no. 125, p. 669, (1911).
(6) N. Bohr, Philosophical Magazine Series 6, vol. 26, no. 153, p. 1, (1913).
(7) Bohr analyse ici l'instabilité mécanique de l'atome et, à ce stade, néglige le rayonnement. En effet, si les électrons sont en mouvement circulaire ou vibratoire, alors, selon les lois de l'électromagnétisme, ils émettent du rayonnement et perdent de l'énergie. De ce point de vue, même le modèle atomique de Thomson s'avère instable.
(8) C'est-à-dire que la théorie n'a pas d'échelle spécifique : il n'existe pas "une unité de longueur" calculée à partir des constantes fondamentales qui interviennent dans cette théorie. Une telle théorie ne peut pas prédire, par exemple, la taille des atomes.
(9) Il suffit de remplacer formellement dans la force d'attraction universelle de Newton les masses par les charges, on obtient la force de Coulomb.
(10) Pour simplifier les notations, on suit Bohr en choisissant un système de mesures où la constante 1/4πε0 est absorbé dans l'unité de mesure de la charge électrique.
(11) En vertu du théorème du viriel (cf. annexe mathématique), l'énergie totale de l'électron est égale à l'énergie cinétique mais de signe opposé (voir l'appendice mathématique). Dans cet article, Bohr note W l'énergie cinétique de l'électron, son énergie totale est donc –W.
(12) On préfère la notation consacrée n à la lettre τ utilisée par Bohr.
(13) Une explication plus moderne est donnée dans l'appendice mathématique.
(14) J. W. Nicholson, Month. Not. Roy. Astr. Soc. 72, pp. 49,130, 677, 693, 729 (1912).
(15) C'est en 1913 que Millikan mesure avec précision la charge de l'électron (voir BibNum, texte de Millikan analysé par I. Pavel, déc. 2010) ; en 1916, il mesure la constante de Planck. Si on utilise les valeurs actuelles, la concordance entre le calcul de Bohr et la valeur expérimentale est remarquable, moins de 0,4% d’écart.
(16) Voir BibNum, texte de Newton (1672) analysé par C. Guthmann, oct. 2010.
(17) Voir BibNum, texte de Kirchhoff et Bunsen (1861) analysé par C. Génin, sept. 2008.
(18) Au moment où Bohr rédigeait la "Trilogie", on connaissait la série de Balmer mais pas encore celles de Lyman et Paschen.
(19) Conformément à l'électrodynamique classique, une charge électrique en mouvement circulaire uniforme avec la fréquence ω émet une onde électromagnétique ayant la même fréquence ω. C’est une conséquence directe de la linéarité des équations de Maxwell : si la source du champ (charge ou courant électrique) varie dans le temps suivant une fonction harmonique, la solution (champ électromagnétique) varie également suivant une fonction harmonique de même fréquence.
(20) On rappelle que Bohr note ω la fréquence de révolution c'est-à-dire l'inverse de la période du mouvement.
(21) Ce résultat, connu et publié auparavant par Nicholson, sera l'hypothèse de départ de la partie II de la "Trilogie" de Bohr.
(22) Par rapport au texte de Bohr, on préfère noter avec N le nombre d'électrons de l'atome afin de ne pas confondre avec le niveau d'énergie de l'atome n.
(23) Perfectionniste, Bohr avait une certaine difficulté pour formuler ses phrases lorsqu’il rédigeait et il faisait beaucoup d’efforts pour chercher le mot approprié.
(24) La structure fine d'une ligne spectrale correspond à sa séparation en plusieurs lignes très proches et ne peut être mise en évidence que par des mesures de spectroscopie très précises.
(25) Bohr connaît en 1913 la structure fine des lignes spectrales de l'hydrogène mais l'attribue à tort, dans un premier temps, au champ électrique des décharges dans les tubes à vide, puis dans un deuxième temps, à l'interaction de l'électron avec le noyau, régie par une force qui n'est pas inversement proportionnelle avec le carré de la distance.
(26) Il est remarquable que ce modèle semi-classique de Sommerfeld pour l'atome de l'hydrogène donne le même résultat que les calculs effectués avec le formalisme de la mécanique quantique relativiste : il suffit de modifier le nombre quantique du moment cinétique pour prendre en compte le spin de l'électron.
(27) N. Bohr, Nature, 121, p. 580 (1928).
(28) C'est en partie la désintégration bêta radioactive (émission d'un flux d'électrons) qui mettait les physiciens sur une fausse piste et considérer que le noyau contient des électrons. Ce n'est qu'en 1932 qu'Enrico Fermi découvre l'interaction faible et expliquer ce phénomène : un neutron peut se transformer en proton, électron et neutrino.
(29) Une autre crise de la physique nucléaire était liée à l'apparente non conservation de l'énergie dans la désintégration bêta radioactive. Bohr pensait qu'il fallait renoncer à cette loi fondamentale. Pauli trouvera la solution en 1930 en proposant l'existence d'une nouvelle particule neutre, très difficile à mettre en évidence, qui emporte cette énergie manquante. Elle sera plus tard appelée neutrino et ne sera détectée qu'en 1956.
(30) N. Bohr, Nature, 138, p. 695 (1936).
(31) Voir la définition de k, donnée en haut du paragraphe « Théorème du viriel ».
(32) Elle apparaît naturellement dans la relation mathématique qui exprime la variation de la longueur d'onde d'un photon diffusé inélastiquement par un électron au repos (effet Compton).
(33) Pour des raisons de simplicité, on utilise l'expression classique de l'énergie cinétique : un calcul relativiste conduit au même résultat. On néglige les facteurs numériques, sels les ordres de grandeurs sont pris en compte.
(34) Celle-ci apparaît dans le modèle atomique de Sommerfeld, comme conséquence de l'introduction de la relativité restreinte dans l'atome de Bohr et explique la structure fine des certaines lignes spectrales.
(35) On utilise un système de mesure où la charge électrique contient le terme 1/4(ε0 utilisé dans le SI).


![]()


![]()
![]() (1)
(1)![]() (2)
(2)![]() (3)
(3)![]()
![]()
![]() (4)
(4)![]() (5)
(5)![]() (6)
(6)![]()


![]() (7)
(7)![]()
![]()
![]()
![]()
![]()
![]()


![]()
![]()
![]()
![]()
![]()
![]()


![]()
![]()
![]() (1)
(1)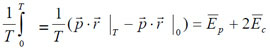
![]()
![]()
![]()
![]()
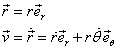
![]() (2)
(2)![]() (3)
(3)![]() (4)
(4)
![]()
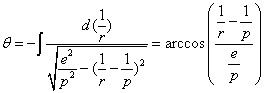
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()















