Une véritable course vers le zéro absolu des températures a débuté avec la première liquéfaction de l’air réalisée indépendamment en 1877 par le français Paul Louis Cailletet (1832–1913) et le genevois Raoul Pictet (1846–1929). Une température d’environ 90 K (-183,15 °C) est alors atteinte. Cette première liquéfaction de l’air marque la naissance d’une nouvelle science qui aura pour objectif l’étude des basses températures et de ses effets : la cryogénie. L’azote sera ensuite liquéfié par les polonais Charles Olszewski (1846–1915) et Sigismond Wroblewski (1845–1888) en 1883, puis il faudra attendre 1898 pour que l’hydrogène soit liquéfié par le britannique James Dewar (1842–1923) à 19,85 K (-253,3 °C) puis solidifié à 15 K (-258,15 °C). Dès 1901, James Dewar s’attaque au dernier gaz atmosphérique jamais liquéfié, l’hélium, mais il échoue, ce gaz semblant impossible à liquéfier.
Le kelvin
Le kelvin est une unité de température mise en place par William Thomson (1824–1907, plus connu sous le nom de Lord Kelvin) au milieu du XIXème siècle. Le kelvin est rapidement adopté par l’ensemble des physiciens de l’époque. En 1702, ayant compris que la température était le résultat de l’agitation moléculaire, l’académicien français Guillaume Amontons (1663–1705) émet l’hypothèse d’un zéro absolu qui correspond à l’absence totale de mouvement. Lord Kelvin fixe alors la température 0 K à la valeur théorique calculée de -273,15°C, tout en gardant l’échelle différentielle de Celsius qui impose une différence de 100 degrés entre la solidification de l’eau et son ébullition à pression atmosphérique. La relation pour passer des degrés Celsius aux degrés kelvin est la suivante :
TK = TC + 273,15.
Depuis 1954, le kelvin est défini par le Bureau International des Poids et Mesures comme la fraction 1/273,16 de la température thermodynamique du point triple de l'eau (cette température est égale à 0,01°C soit 273,16 K).
Heike Kamerlingh Onnes commence dès 1882 la course au froid à l’université de Leyde aux Pays-Bas. C’est un expérimentateur mais, contrairement à ses concurrents, il est aussi très attaché à la théorie, plus particulièrement à l’électromagnétisme de Hendrik Antoon Lorentz (ce dernier l’avait placé à la chaire de physique expérimentale de l’université de Leyde) et à la théorie moléculaire de la matière développée en 1873 par le hollandais Johannes Diderik van der Waals (1837–1923), avec qui il entretient d’étroits rapports. Il commence d’ailleurs sa note à l’Académie des sciences en soulignant l’importance de cette théorie pour l’obtention de l’hélium liquide :
« Le premier pas vers la liquéfaction de l’hélium, d’après la théorie de M. Van Der Waals, a été la détermination des isothermes […] »
Van der Waals modifie l’équation d’état des gaz parfaits jusqu’alors utilisée pour lier la pression, la température, le volume et la quantité de matière d’un gaz. Il y ajoute deux nouveaux termes permettant de rendre compte des différentes forces intermoléculaires dans les gaz appelées forces de van der Waals. Ces fameuses isothermes sont les courbes liant la pression au volume à température constante. En les traçant expérimentalement, il est possible de déduire la température et la pression critiques d’un élément en utilisant l’équation d’état de van der Waals. Onnes estime ainsi la température critique de l’hélium entre 5 K et 6 K dans un précédent communiqué en 1907
(1), ce qui est tout à fait juste.
Point critique thermodynamique
Les différentes phases (gaz, liquide et solide) d’un élément varient en fonction de sa pression et de sa température. La distinction gaz/liquide n’est possible qu’en dessous d’une certaine pression et d’une certaine température dites critiques. Il est donc impératif pour liquéfier un gaz d’être sous la température et la pression critiques.
Les points critiques de l’hélium et de l’eau sont les suivants :
Hélium : Tc = 5,2 K et Pc = 2,23 bar
Eau : Tc = 647,15 K et Pc = 218 bar
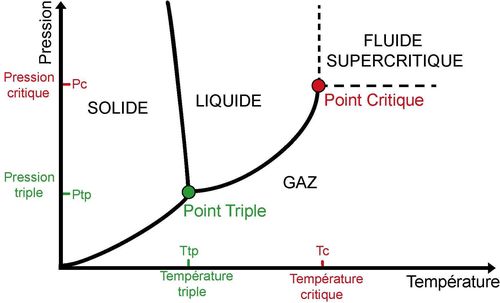
Figure 1 : Diagramme de phase d’un élément pur
La distinction entre deux phases n’est possible que s’il y a échange d’énergie à pression et à température constantes lors du changement de phase. Par exemple, il faut apporter de l’énergie pour vaporiser un liquide (passage de l’état liquide vers l’état gazeux) alors qu’il faut retirer de l’énergie à un gaz pour le liquéfier (passage de l’état gazeux vers l’état liquide). Cette quantité d’énergie associée au changement de phase s’appelle la chaleur latente. Au delà du point critique, il n’y a plus de chaleur latente et il n’y a donc plus de différence entre l’état liquide et l’état gazeux, on parle alors de fluide supercritique.
Il existe un autre point remarquable, le point triple, qui correspond à l’état thermodynamique dans lequel les 3 phases sont mélangées. Pour l’eau, le point triple se situe à une température de 273,16 K et une pression de 0,006 bar.
Onnes poursuit plus loin en insistant sur l’importance des relations entre théorie et technologie pour liquéfier l’hélium :
« [..] J’ai signalé aussi l’importance qu’ont eue pour le succès, à côté de la théorie de M. van der Waals, les moyens que M. Dewar a mis à la disposition des physiciens.»
Il fait entre autre allusion au fameux vase inventé par James Dewar qui porte son nom. Un vase dewar est un cryostat – une enceinte permettant de conserver les fluides cryogéniques à très basse température – permettant de minimiser les pertes thermiques. Ces pertes sont de trois types : les pertes par conduction dues au transport de la chaleur dans un matériau, les pertes par convection dues à l’échange de chaleur via un écoulement fluide et les pertes par rayonnement issues du fait que tout corps possédant une température non nulle émet un rayonnement thermique (rayonnement du corps noir). Un dewar est composé de deux vases de faible épaisseur (en verre ou en métal) imbriqués et séparés l’un de l’autre par un espace dans lequel on fait le vide de manière à diminuer les pertes par convection. Les points de contact entre les deux vases sont réduits pour minimiser les pertes par conduction et de l’argent est déposé sur les parois pour diminuer les pertes par radiation car l’argent possède une très faible émissivité thermique. Onnes va encore plus loin pour diminuer les pertes thermiques tout en se laissant la possibilité d’observer le liquide pour son expérience :
« L’hélium liquide est recueilli dans le fond non argenté d’un verre évidé à double paroi, argenté pour le reste. La partie transparente est entourée par de l’hydrogène liquide dans un verre évidé à double paroi, entouré lui-même d’un verre semblable rempli d’air liquide, qui est entouré à son tour par un verre d’alcool qu’on tient un peu chauffé par une circulation. »
Onnes avait ainsi mis en place un « écrantage thermique », indispensable pour que l’hélium liquide ne s’évapore pas immédiatement car les chaleurs latentes de vaporisation (l’énergie nécessaire pour évaporer une quantité donnée de liquide) de l’oxygène, de l’azote et de l’hydrogène sont nettement supérieures à celle de l’hélium : à titre de comparaison, il faut 447 joules pour évaporer 1 gramme d’hydrogène contre seulement 21 joules pour évaporer 1 gramme d’hélium à pression atmosphérique. Les pertes par radiation sont proportionnelles à la puissance quatrième des températures suivant la loi de Stefan-Boltzmann ; le fait de mettre en place une succession de boucliers thermiques diminue donc énormément les pertes par radiation au niveau de l’hélium : la puissance perdue par rayonnement entre 4 K et 80 K est 256 fois plus importante que la puissance perdue entre 4 K et 20 K. L’alcool qui circule permet, quant à lui, d’évacuer la chaleur vers l’extérieur (voir Figure 2).
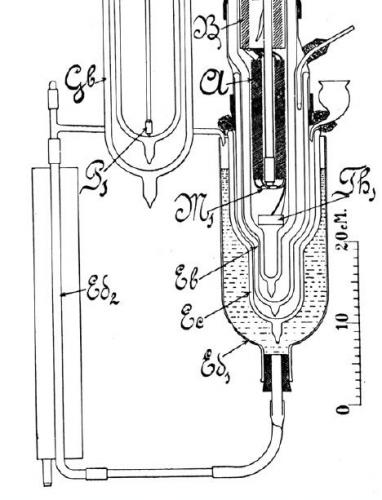
Figure 2 : Schéma de la partie terminale du liquéfacteur d’hélium de Kamerlingh Onnes.
Au centre, 4 tubes en verre évidé imbriqués les uns dans les autres. L’hélium liquide recueilli au centre est entouré d’hydrogène liquide qui est entouré d’air liquide, lui-même entouré d’alcool circulant pour extraire la chaleur et empêcher l’évaporation de l’hélium liquide.
Au début du vingtième siècle, la plupart des scientifiques expérimentateurs travaillaient dans de petits laboratoires avec peu de moyens. Kamerlingh Onnes est le premier à construire un laboratoire académique quasi-industriel dédié à la cryogénie tout en réunissant des physiciens, chimistes et mécaniciens pour mener à bien ses expériences. Il ira même jusqu’à fonder une école de souffleurs de verre à Leyde, indispensables pour fabriquer les différentes parois en verre du dispositif.

Figure 3 : H.K. Onnes (à droite) et G.J. Flim (à gauche), chef du laboratoire de cryogénie, devant le liquéfacteur d’hélium à l’université de Leyde en 1908.
Pour liquéfier l’hélium, Onnes utilise le principe de Joule-Thomson (ou Joule-Kelvin) qui consiste à faire subir à un gaz une très forte détente adiabatique, c’est-à-dire abaisser la pression subitement sans échange de chaleur avec l’extérieur. Cette transformation peut se réaliser facilement en faisant passer un gaz à travers un petit orifice comme une vanne. Si cette détente est effectuée sous une certaine température, appelée température d’inversion, la température baisse fortement, et si la température avant la détente est suffisamment proche du point critique, le gaz peut être liquéfié. Onnes utilise un compresseur de Cailletet qu’il a lui-même modifié pour compresser l’hélium, afin d’obtenir des pressions d’environ 100 bar (voir Figure 4). L’hélium à haute pression subit ensuite une succession de refroidissements en cascade : il est tout d’abord refroidi avec de l’air liquide, puis avec de l’hydrogène liquide jusqu’à environ 15 K, la limite de solidification de l’hydrogène. Il était très important de bien contrôler la température de l’hydrogène car, en gelant, l’hydrogène solide aurait empêché d’observer l’hélium liquide. Finalement, une détente de Joule-Thomson est effectuée à travers un petit orifice indiqué par la légende M1 sur la Figure 2.

Figure 4. Compresseur de Cailletet à plongeur de mercure utilisé par Kamerlingh Onnes pour compresser de l’hélium jusqu’à 100 bars. Il est exposé au musée de Boerhaave près de Leyde dans la salle dédiée à la liquéfaction de l’hélium (Photo Boerhave Museum, Leyde, Pays-Bas)
Après quatorze heures d’intenses efforts, l’hélium liquide est aperçu pour la première fois et Onnes est impressionné par l’apparence de ce nouveau liquide :
« L’expérience a commencé le 10 juillet à 5h45 du matin (…) À 4h20, l’hélium commençait à circuler. À 7h30, l’hélium liquide est observé pour la première fois »
« En regardant à travers les trois verres, on voyait à la fois les ménisques de l’air liquide, de l’hydrogène liquide et de l’hélium liquide. La différence de ce dernier liquide exceptionnel avec les autres sautait aux yeux. La capillarité de l’hélium est extrêmement petite ; la surface de l’hélium liquide s’applique contre les parois comme la lame d’un couteau. »
Onnes avait raison de s’étonner car l’hélium liquide possède des propriétés thermodynamiques et mécaniques uniques, comme sa viscosité extrêmement faible. Les mesures effectuées étaient extrêmement précises pour l’époque : Onnes estime la densité du précieux liquide à 0,154 g/cm3 et la température d’ébullition à 4,5 K (les valeurs réelles sont de 0,125 g/cm3 et 4,2 K à pression atmosphérique). Une fois le liquide obtenu, le liquide et le gaz cohabitent dans la même enceinte, ils sont alors en équilibre thermodynamique. Le mélange se situe sur la ligne de saturation gaz/liquide dans le diagramme de phase, voir la Figure 1. S’il n’y a pas d’échange de chaleur avec l’extérieur, cet équilibre est conservé, donc si la pression de l’enceinte diminue, alors le mélange gaz/liquide doit « suivre » la ligne de saturation, ce qui a pour effet de diminuer la température. Si cette pression baisse suffisamment, on doit atteindre le point triple, point auquel les trois états (liquide, gaz et solide) coexistent ensemble. Onnes s’étonne de ne pas être arrivé au point triple de l’hélium mais pense qu’il est simplement plus loin que prévu :
« L’hélium ne s’est pas solidifié lorsque la pression de vapeur a été diminuée. La communication avec la grande pompe à vide n’était pas assez bonne cette fois, mais il est certain que je suis allé jusqu’ à 1cm, peut être même jusqu’à 7mm. Le liquide, à cette température, était encore extrêmement mobile. S’il se comportait conne le pentane il ne deviendrait solide que vers 1°K. »
Onnes dit avoir pompé à l’aide d’une pompe à vide jusqu’à une pression de 10mm, voire 7mm (de mercure). Ceci correspond à des pressions de 13,3 mbar et 9,3 mbar, soit des températures équivalentes pour un équilibre liquide/gaz de 1,74 K et 1,65 K. Il pensait légitimement atteindre le point triple de l’hélium en descendant encore en température mais il ne savait pas encore que l’hélium ne possède pas de point triple à cause d’une quatrième phase appelée superfluide et découverte en 1937 (l’hélium solide existe bel et bien mais pour des pressions de l’ordre de 25 bar pour des températures inférieures à 3,5 K (voir figure 5). En fait, Onnes a dû obtenir sans le savoir de l’hélium superfluide lors du pompage à partir de 50 mbar (soit 2,17 K), mais il n’a pas pu voir ce changement de phase difficile à détecter dans son expérience de l’époque. Néanmoins, lors de mesures dans les années suivantes, il remarquera un pic de densité du liquide autour de 2,2 K et une anomalie de la chaleur spécifique autour de ce point mais il ne publiera pas ces observations pensant qu’elles étaient dues à des erreurs expérimentales, ce qui en fait n’était pas le cas ! Le liquide était donc effectivement très mobile puisque l’hélium superfluide ne possède pas de viscosité. Dans le dernier paragraphe, on ne peut que constater l’optimisme et la vision d’avenir de Onnes :
« Naturellement, il sera plus difficile de faire des recherches avec l’hélium liquide qu’avec l’hydrogène liquide. Mais il ne faut pas mesurer les difficultés par celle de la première liquéfaction. Une fois les conditions pour obtenir l’hélium liquide bien connues, la plus grande difficulté est levée, et l’on peut concentrer ses efforts sur l’emploi du nouveau gaz liquéfié. »
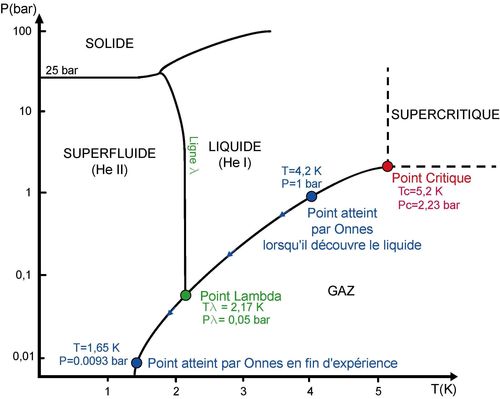
Figure 5 : Diagramme de phase de l’hélium.
L’originalité de l’hélium vient du fait qu’il possède deux phases liquides: une phase liquide normale (He I) et une phase liquide superfluide (He II). L’hélium ne possède donc pas de point triple mais un point dit « lambda » à l’intersection des phases gazeuse, liquide et superfluide.
Kamerlingh Onnes se démarquait des autres expérimentateurs en cryogénie de son époque dans le sens où, pour lui, la liquéfaction de l’hélium n’était pas une fin en soi. L’hélium liquide était un moyen de refroidir encore plus des échantillons pour apporter une meilleure connaissance des phénomènes physiques (thermodynamiques, mécaniques, électriques, etc.) à basse température. Les physiciens de l’époque commençaient déjà à éprouver le besoin d’utiliser la cryogénie pour leurs expériences et Onnes l’avait parfaitement compris. Il cite d’ailleurs les travaux de Jean Becquerel, le fils d’Henri Becquerel, avec lequel Kamerlingh Onnes a travaillé à Leyde sur ce que Jean Becquerel appelait les « électrons positifs»
(2) car ce dernier avait besoin de réaliser ses expériences à très basse température et le laboratoire de Onnes était le plus perfectionné de l’époque. Par la suite, la physique quantique expérimentale sera très dépendante de la cryogénie à l’hélium liquide pour étudier les particules et les atomes à ultra basse température.
En quelques années, Onnes domestiquera la liquéfaction de l’hélium et portera toutes ses recherches sur la résistivité électrique à basse température. Il commencera avec du platine puis de l’or en voulant démontrer sa théorie : plus le métal est pur, plus la résistivité chute lorsque la température diminue. Il décide alors d’utiliser du mercure, liquide à température ambiante et donc facile à purifier. C’est ainsi qu’en 1911, lors de tests expérimentaux sur la résistivité du mercure dans l’hélium liquide, que l’étudiant de Kamerlingh Onnes, Gilles Holst, observe pour la première fois ce que Onnes appellera deux ans plus tard, dans une communication à l’Académie des sciences des Pays-Bas,
la supraconductivité (3). Mais cela ne correspondait pas à la théorie de base formulée par Onnes car la résistivité chutait vers zéro brutalement, devenant inférieure au seuil de détection des appareils (voir Figure 6). Ce phénomène fut ensuite reproduit avec d’autres métaux mais Onnes ne parvint jamais à expliquer ce phénomène nouveau. Il faudra attendre 1956 pour avoir les premières explications quantiques de la supraconductivité avec la théorie BCS (acronyme des de ses découvreurs, John Bardeen, Leon Cooper et John Robert Schrieffer
(4) ) basée sur la formation de paires d’électrons dans les supraconducteurs.
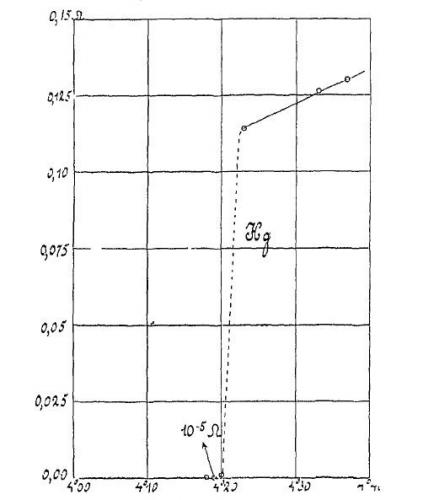
Figure 6. Relevé de la résistivité du mercure faite en 1911 au laboratoire de Leyde en fonction de la température (5). On voit la complète disparition de la résistivité à 4,2 K. Cette observation a été rendue possible grâce à la liquéfaction de l’hélium trois ans plus tôt dans ce même laboratoire.
Supraconductivité et superfluidité
La supraconductivité est le phénomène de transport de l’électricité sans résistance au courant (résistance nulle) et la superfluidité est le phénomène d’écoulement fluide sans résistance mécanique (viscosité nulle). Ces deux phénomènes directement issus de la liquéfaction de l’hélium par Onnes en 1908 n’ont été expliqués que cinquante ans après leur découverte, sur les bases de la physique quantique. Ce sont les deux seuls phénomènes quantiques macroscopiques observables directement.
Aujourd’hui, la supraconductivité est utilisée à des fins scientifiques et industrielles dans de nombreux domaines comme la physique des particules ou l’imagerie médicale qui utilisent des aimants supraconducteurs généralement refroidis avec de l’hélium liquide.
Un aimant supraconducteur est un électro-aimant – une bobine conductrice traversée par un courant électrique et générant ainsi un champ magnétique – utilisant un matériau supraconducteur refroidi sous sa température critique (température sous laquelle le matériau est supraconducteur). Ce type d’aimant est peu encombrant et génère de puissants champs magnétiques permettant par exemple de courber des faisceaux de particules chargées, afin de leur conserver une trajectoire circulaire leur permettant de passer à plusieurs reprises dans les cavités accélératrices rectilignes.
Exactement 100 ans après la liquéfaction de l’hélium par Onnes, l’Organisation Européenne pour la Recherche Nucléaire (CERN) à Genève vient de démarrer son nouvel accélérateur de particules, le LHC (Large Hadron Collider) qui constitue la plus grande installation supraconductrice et cryogénique du monde. Le LHC est composé de 27 km d’aimants supraconducteurs en niobium-titane générant des champs magnétiques de 8 teslas. Pour cela, de gigantesques installations cryogéniques à hélium ont été développées. Tous les aimants baignent dans des bains statiques pressurisés d’hélium superfluide à 1,9 K et la chaleur est extraite via une circulation d’hélium superfluide saturé à 1,8 K. Au total, 60 tonnes d’hélium liquide (normal et superfluide) sont utilisés pour refroidir les 36 800 tonnes de la machine.

(1) Kamerlingh Onnes, H. «Isotherms of monatomic gases and their binary mixtures. I. Isotherms of helium between +100°C and -217°C»,
Proceedings of the Royal Netherlands Academy of Arts and Sciences, 10 II, 1907-1908, Amsterdam, 1908, pp. 445-450
(2) Jean Becquerel. «Sur les électrons positifs»,
Radium (Paris) 5, 1908, pp. 193-200
(3) Kamerlingh Onnes, H. «Further experiments with liquid helium. H. On the electrical resistance of pure metals etc. VII. The potential difference necessary for the electric current through mercury below 4°19K»,
Proceedings of the Royal Netherlands Academy of Arts and Sciences, 15 II, 1912-1913, Amsterdam, 1913, pp. 1406-1430
(4) John Bardeen (1908-1991) a été prix Nobel de physique à deux reprises, en 1956 pour le transistor et en 1972 pour la supraconductivité ; Leon Cooper (né en 1930) et John Schrieffer (né en 1931) ont obtenu le prix Nobel en 1972 avec Bardeen pour la supraconductivité.
(5) Kamerlingh Onnes, H. «Further experiments with liquid helium. G. On the electrical resistance of pure metals etc. VI. On the Sudden Change in the Rate at which the Resistance of Mercury Disappears»,
Proceedings of the Royal Netherlands Academy of Arts and Sciences, 14 II, 1911-1912, Amsterdam, 1912, pp. 818-821
 La liquéfaction de l’hélium par Kamerlingh Onnes en 1908 ouvre la voie vers la cryogénie à l’hélium et permettra la découverte de la supraconductivité trois ans plus tard.
La liquéfaction de l’hélium par Kamerlingh Onnes en 1908 ouvre la voie vers la cryogénie à l’hélium et permettra la découverte de la supraconductivité trois ans plus tard.


















