Entre 1859 et 1862, deux physiciens allemands et professeurs à Heidelberg, Gustav Kirchhoff (1824-1887) et Robert Bunsen (1811-1899) établissent l’analyse spectrale comme méthode d’analyse chimique pour détecter la présence d’éléments, procédé utilisable en astronomie.
Après une communication
(1) de Kirchhoff à l’Académie des Sciences de Berlin en 1859, Kirchhoff et Bunsen écrivent deux mémoires dans les
Annales de Poggendorf (2). Le premier établit la méthode tandis que le second la valide par la découverte de nouveaux éléments chimiques, le césium et le rubidium.
Ces deux mémoires sont traduits par leurs auteurs, en français, dans les Annales de Physique et de Chimie en 1861 et 1862
(3). Si dans l’ensemble, les textes français respectent les originaux, ils en diffèrent dans le détail, notamment dans les descriptions des expériences. En outre, le premier mémoire français prend acte des avancées des travaux des auteurs. Il anticipe sur le second texte en évoquant la découverte des éléments en 1860.
Spectres d’absorption - spectres d’émission
La lumière d’un arc en ciel est composée de toutes les couleurs du visible, du bleu au magenta. Chaque couleur est un rayon lumineux visible auquel est associée une grandeur appelée longueur d’onde. Un ensemble de rayons séparés selon leur longueur d’onde, est appelé spectre.
- La lumière blanche du soleil décomposée dans un arc-en-ciel ou dispersée par un prisme forme un spectre continu car toutes les couleurs sont présentes.
- Le spectre émis par un atome lorsqu’il est chauffé, est discret car il ne contient qu’un nombre restreint de rayons. Il apparaît des raies de lumière sur un fond noir (cf. figure 1, spectres n°2 à 7).
- Inversement, la lumière blanche est partiellement absorbée par des atomes chauffés. L’absorption entraîne la baisse d’intensité lumineuse pour les mêmes longueurs d’onde que celles émises. Après dispersion de la lumière absorbée, il apparaît des raies sombres ou noires sur un fond irisé (cf. figure 1, spectres n°1).
Ces propriétés des atomes existent aussi pour des molécules, ainsi que pour d’autres rayonnements comme l’ultraviolet (UV).
Dans l’introduction du premier mémoire, l’objectif est clairement affirmé dès les premières lignes :
« On peut fonder sur l’existence de ces raies une méthode d’analyse qualitative qui élargit considérablement le domaine des investigations chimiques et permet de résoudre des problèmes jusqu’ici inabordables. Nous nous bornerons dans ce mémoire à appliquer cette méthode à la recherche des métaux alcalins et alcalino-terreux. »
L’étude est restreinte à ces quelques éléments. Ainsi selon le texte, seuls les spectres de 6 métaux (les alcalins sodium, potassium, lithium et les alcalinoterreux
(4) calcium, strontium et baryum, cf. figure 1), avec le spectre solaire, sont présentés sur une planche par Kirchhoff et Bunsen. Cependant un septième spectre métallique (celui du césium, alcalin) est également inséré dans la planche du mémoire traduit en français (cf. 3ème partie, planche annexée à l’article).
Pour obtenir des raies brillantes, une lampe à gaz conçue par Bunsen, peu éclairante mais plus énergétique est utilisée.

Figure 1 : Planche de spectres extraite de l’ouvrage Le monde physique, par Amédée Guillemin (1826-1893), Hachette Paris, 1882. Spectre n°1 = spectre d’absorption dans le spectre solaire observé par Joseph Fraunhofer (1787-1826), avec les lettres caractérisant les raies d’absorption. Spectres n°2 à 7 = spectres d’émission des éléments analysés par Kirchhoff et Bunsen : sodium Na, potassium K, lithium Li, calcium Ca, strontium Sr et Baryum Ba. L’échelle est arbitraire, elle serait en longueur d’onde sur des planches modernes.
@@@@@@@
La première partie du mémoire décrit le mode opératoire et l’instrument, le spectroscope.
L’obtention des chlorures de calcium, de sodium, de lithium, de strontium et de baryum est réalisée par une succession de précipitations et de recristallisations, de manière à utiliser pour les expérimentations, des composés :
« Aussi purs que possible. »
Plus loin dans le mémoire, les auteurs associent aux éléments d’autres bases (des iodures, des bromures…) que les chlorures pour montrer leur inaction sur les résultats de l’analyse spectrale. La pureté des produits testés consolide alors l’interprétation des résultats.
Le spectroscope (cf. figure 2a) est l’instrument qui permet la dispersion de la lumière et l’observation des spectres, ainsi que le repérage de la position des raies. Il comprend deux lunettes, un prisme dispersif et une échelle graduée. Une flamme est placée devant l’une des lunettes et sa lumière est observée par l’expérimentateur à l’oculaire de la deuxième lunette. Une note de Louis Grandeau (1834-1911), chimiste puis agronome, précise l’existence d’un deuxième modèle préférable dont la description viendra ultérieurement dans les Annales (cf.figure2b).
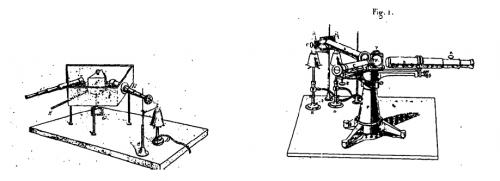
Figure 2 : dessins a) (à gauche) du 1er modèle de spectroscope, b) (à droite) du 2ème modèle de Kirchhoff et Bunsen, extraits de leur premier et deuxième mémoire respectivement (le premier mémoire est celui qui figure dans le site BibNum).
Après avoir présenté l’appareil et la préparation des réactifs, Kirchhoff et Bunsen décrivent leurs premières expériences qui évaluent l’influence de la nature des sels, du type de flamme et de leur température. Ils comparent également les résultats à ceux obtenus avec une étincelle électrique.
Outre des chlorures, les auteurs testent des bromures, des iodures, des hydrates, des carbonates et des sulfates. Ces sels induisent des phénomènes chimiques divers et une « énorme différence » de température mais la conclusion est que ces perturbations :
« N’exercent aucune influence sur la position des raies du spectre correspondant à chaque métal. »
Quant à la flamme, Kirchhoff et Bunsen examinent l’influence de sa température en regard de la volatilité des composés, c'est-à-dire leur capacité à passer de l’état liquide à l’état gazeux sous l’action de la chaleur. Ainsi pour le sodium :
« la réaction est la plus nette, lorsqu’on emploie ce corps à l’état d’oxyde, de chlorure, de bromure ou d’iodure (…) cependant elle ne manque jamais avec le silicate, le borate, le phosphate et les autres sels de soude indécomposables par la chaleur. »
Confirmant l’énoncé de l’introduction, ils constatent que :
« Une même combinaison (chimique) donne un spectre d’autant plus intense que la température est élevée ; et que de toutes les combinaisons d’un même métal, c’est le plus volatile qui, pour une même flamme, donne les raies les plus intenses. »
Enfin, lorsque l’étincelle électrique remplace la flamme :
« Les raies brillantes du spectre de la flamme se produisent sans changement de position dans le spectre de l’étincelle. »
Comme la position des raies ne dépend ni de la source d’énergie, ni du type de flamme, de sa température, ou de la composition chimique des sels contenant le métal, la conclusion générale (page 7) est la suivante :
« Il paraît donc hors de doute que les raies brillantes constituent un moyen infaillible pour reconnaître la présence des métaux alcalins et alcalino-terreux. Elles sont un réactif plus sûr et plus rapide que tout autre moyen analytique connu, pour déceler de très petites quantités de ces corps. »
L’analyse spectrale, avec l’utilisation des spectres d’émission, est une nouvelle technique d’analyse chimique qualitative aux propriétés intéressantes. Outre la rapidité et la certitude de détection, il reste à déterminer les seuils de perception, c’est l’objet de la deuxième partie.
La deuxième partie (à partir de la page 7) cherche à montrer l’influence de la nature des sels sur les spectres de manière plus détaillée pour chaque métal analysé. Pratiquement, il s’agit de déterminer quelles sont les raies à utiliser parmi celles qui apparaissent dans les spectres et s’il n’y a pas de superposition de raies entre plusieurs métaux. Kirchhoff et Bunsen essaient de trouver la limite de détection, et quelques applications pratiques.
« Nous tâcherons en même temps de faire ressortir les avantages que l’analyse chimique peut tirer de ces phénomènes.»
Avec le sodium, une raie de couleur jaune est particulière ; il est bien connu maintenant que cette raie est la plus facilement visible quelle que soit la nature de la lumière, ce que Kirchhoff et Bunsen ne manquent pas de noter :
« De toutes les réactions du spectre, celle que présente le sodium est la plus sensible.»
Et les auteurs rajoutent :
« L’expérience montre bien que jusqu’à présent la chimie ne peut, même de loin, mettre aucune réaction en parallèle avec celle du spectre, quant à la sensibilité. »
Cette sensibilité extrême serait utile pour suivre par exemple la quantité de sodium dans l’air et la lier à l’apparition de certaines maladies.
Pour le lithium, l’analyse spectrale
« surpasse aussi en sensibilité et certitude toutes les réactions connues de l’analyse chimique ordinaire. »
L’application pratique concerne l’analyse des roches, laquelle amène à un résultat nouveau et important en géologie :
« Ces expériences ont conduit à ce fait assez inattendu que La lithine est un des corps les plus généralement répandus dans la nature (...) On constate ainsi la présence de lithine dans de nombreux feldspaths, par exemple dans l’orthose de Baveno (…) On a pu constater de même sa présence dans les eaux d’une source de la pente occidentale du Neckar, tandis que l’eau de notre laboratoire, ayant sa source dans le grès bigarré, n’en contient pas. »
Cette conclusion permet alors de choisir l’analyse spectrale comme outil de décision pour les préparations industrielles, le choix des matières premières et celui des modes d’extraction. Au cours du procédé, la rapidité de la méthode en fait aussi un moyen de contrôle.
Avec le potassium s’achève l’étude des alcalins et les auteurs font une remarque importante en écartant la superposition éventuelle de raies de métaux différents (page 15) :
« La présence de la lithine, aussi bien que celle de la soude, est sans influence sur l’observation des raies du potassium. »
Puis démarre l’étude des alcalino-terreux, le strontium et le calcium, pour lesquels les spectres sont plus complexes. Mais systématiquement, un choix de raies caractéristiques propres à chaque métal est réalisé, ainsi qu’une estimation de leur limite de sensibilité. Le mode opératoire est précisé pour chaque sel. L’influence des autres métaux est examinée ; à propos du calcium, Grandeau ajoute une remarque sur l’existence d’une raie qui n’est visible qu’avec le 2ème modèle de spectroscope.
Un premier bilan est tiré de ces expériences avant que les auteurs poursuivent avec le baryum. Outre la sensibilité, la rapidité d’analyse, Kirchhoff et Bunsen pointent la simplicité de la méthode notamment en donnant un exemple d’analyse du strontium. Ils notent aussi à propos de leur méthode (page 20) :
« Ces essais se font en outre très rapidement et n’exigent que de très petites quantités de substance, ce qui n’a pas lieu dans les procédés analytiques ordinaires. »
Douze exemples d’applications suivent. Kirchhoff et Bunsen analysent de l’eau de mer, des eaux minérales, des cendres de cigare, des verres et des roches. L’accès à la composition des calcaires ouvre de nouvelles perspectives pour les géologues sur la connaissance de l’histoire de la terre et des mers. L’apparition des raies caractéristiques montre la présence éventuelle de sodium, de potassium, de lithium, de calcium ou de strontium ; les auteurs notent que l’analyse, par exemple de l’eau minérale, se fait en une fois, à la différence des méthodes traditionnelles par réactifs chimiques (page 21) :
« On fait donc en quelques instants, seulement à l’aide de l’œil et par l’évaporation d’une seule goutte de liquide, l’analyse complète d’un mélange de cinq corps. »
Avec le baryum, le spectre est plus compliqué mais l’analyse d’un mélange est possible, avec une conclusion qui renforce le lien unique entre les raies et un métal :
« L’absence de l’un ou l’autre de ces métaux dans le mélange est signalée immédiatement par l’absence même des raies qui lui sont propres.»
Après ces monographies par éléments, les auteurs synthétisent les observations et ouvrent de nouvelles perspectives (page 26).
Kirchhoff et Bunsen commencent par mettre en parallèle l’analyse spectrale et l’analyse chimique par précipitation, la seule méthode alors courante en laboratoire pour caractériser un élément. Les deux méthodes reposent a priori sur des observations de couleur et d’aspect à partir d’une faible quantité d’échantillon. Mais l’observation des spectres est moins subjective et repose sur des critères objectifs qui en font une technique à privilégier :
« Les couleurs des raies au contraire apparaissent intactes et leur pureté ne varie nullement avec la présence de matières étrangères. Les positions que ces raies occupent dans le spectre impliquent une propriété chimique capitale et d’une nature aussi immuable que le poids atomique lui-même, et se laissent par suite déterminer avec une exactitude presque mathématique. »
Cette rigueur dans l’interprétation des spectres est associée à une extrême sensibilité qui :
« recule les limites, auxquelles on avait dû jusqu’ici s’arrêter dans la connaissance des propriétés chimiques de la matière. »
Enfin, Kirchhoff et Bunsen envisagent également que la méthode :
« pourra conduire à la découverte d’éléments encore inconnus (.. .) S’il existe en effet des corps disséminés en assez petites quantités dans la nature pour avoir échappé à nos moyens ordinaires d’analyse, on peut espérer les découvrir par la simple inspection du spectre.»
Anticipant sur le second mémoire, ils annoncent la découverte du césium, quatrième métal alcalin. Grandeau, dans une note, avise le lecteur que Kirchhoff et Bunsen confirment cette découverte et celle du rubidium dans le second mémoire à paraître. Grandeau lui-même participera à la recherche de ces métaux dans les eaux et les végétaux. Cette insertion justifie la présence du spectre du césium dans la planche des Annales (en fin du texte BibNum), ce qui n’avait pas été prévu dans l’introduction.
Non seulement l’analyse spectrale possède des qualités supérieures à l’analyse chimique ordinaire, mais en plus elle offre un moyen indispensable pour augmenter les connaissances scientifiques en chimie, en géologie ou en astronomie. C’est ce que Kirchhoff et Bunsen démontrent dans la suite du texte.
Le texte au début de ce mémoire commence par un état des lieux des connaissances : une substance introduite dans une flamme produit des raies brillantes dans un spectre. La dernière partie conserve la même structure générale : en premier, elle reprend et complète les conclusions de recherches précédentes.
« Il a été démontré
(5) par des considérations théoriques que le spectre d’un gaz en combustion se trouve renversé, c'est-à-dire que les raies brillantes deviennent obscures lorsqu’un foyer lumineux… se trouve placé en arrière de la flamme de ce gaz. »
Le spectre solaire avec les raies obscures est le spectre renversé de l’atmosphère du soleil.
« On peut conclure de ce fait que le spectre solaire avec ses raies obscures n’est autre que le spectre renversé de l’atmosphère du soleil. Par conséquent, pour analyser l’atmosphère solaire il suffit de rechercher quels sont les corps qui, introduits dans une flamme, donnent des raies brillantes coïncidant avec les raies obscures du spectre solaire. »
Si une raie d’émission d’un métal se trouve à la même position qu’une raie sombre d’absorption, la présence du métal absorbant est confirmée. Kirchhoff et Bunsen rappellent succinctement les preuves expérimentales pour le sodium et le lithium, décrites dans le mémoire sur ce sujet. Puis ils présentent d’autres confirmations après avoir renversé le spectre du potassium, du calcium, du strontium et du baryum.
Ainsi prend fin ce premier mémoire qui reprend les conclusions de plusieurs communications ou publications allemandes, mais qui tient également compte des avancées les plus récentes de la science en marche, pour proposer au lecteur français de l’époque une méthode d’analyse spectrale aussi bien valable pour détecter les composés terrestres avec les spectres d’émission, que pour identifier les éléments des corps célestes grâce aux spectres d’absorption.
On peut également apprécier la démarche scientifique à travers l’articulation du mémoire qui, pour chaque type d’analyse, part des acquis pour aller vers la nouveauté. Les auteurs exposent le mode opératoire avec les problèmes de flamme, d’instrument et d’obtention de produits purs, puis ils essaient tous les métaux sous diverses configurations ou en mélange pour trouver les meilleures conditions de détection. Enfin ils comparent l’analyse spectrale, un des premiers procédés physique d’analyse, avec des méthodes purement chimiques, en montrant la puissance de la spectroscopie par l’identification et la découverte d’un nouvel élément. Ils réunissent en une seule méthode l’analyse par émission pour les métaux terrestres et celle par absorption pour l’atmosphère solaire. L’analyse spectrale est applicable aussi bien par les chimistes, les géologues que les astronomes.

PS : En fin d’article des Annales, un extrait d’une lettre de Kirchhoff à M. Erdmann, en date du 6 août 1860, donne des précisons sur le protocole qui permet d’observer simultanément deux spectres pour les comparer : l’utilisation notamment de l’étincelle électrique avec un appareil spécifique permet d’obtenir un spectre d’émission très intense et complet. La comparaison entre celui-ci et le spectre d’absorption du soleil permet de supposer la présence de fer, de cuivre, de nickel et de magnésium dans l’atmosphère du soleil et l’absence d’autres éléments comme l’argent ou le zinc. Kirchhoff conclue à l’utilisation probable de la spectroscopie pour l’analyse des métaux dans des matériaux terrestres.
(1) G. Kirchhoff, communication du 20 Octobre 1859.
(2) G. Kirchhoff , R. Bunsen,“Chemische Analyse durch Spectralbeobachtungen“, Annalen der Physik und Chemie, CX, 6 (1860): 161-189 et CXIII, 7 (1861) : 337-381.
(3) G. Kirchhoff, R. Bunsen, “Analyse chimique fondée sur les observations du spectre“, Annales de Chimie et de Physique, 3, LXII (1861) : 452-486 et 3, LXIV (1862) : 257-311.
(4) Les alcalins constituent la première colonne du tableau de Mendeleïev, les alcalino-terreux la seconde.
(5) G. Kirchhoff , “Über der Verhältnis zwischen dem Emissionsvermögen und dem Absorptionsvermögen der Körper für wärme und Licht“, Annalen der Physik und Chemie, CIX, 6 (1860) : 275-301, ou, en français, dans G. Kirchhoff, “Du rapport entre le pouvoir émissif et le pouvoir absorbant des corps pour la chaleur et la lumière“, Annales de Chimie et de Physique, 3, LXII (1861) : 160-192. Kirchhoff arrive à la même conclusion quant à l’utilisation des spectres pour déterminer la composition chimique de l’atmosphère solaire.
 Cet article est la traduction française de l’article publié par Kirchhoff et Bunsen dans une revue allemande en 1860, et traduit par les auteurs eux-mêmes dans les Annales de physique et de chimie un an plus tard.
Cet article est la traduction française de l’article publié par Kirchhoff et Bunsen dans une revue allemande en 1860, et traduit par les auteurs eux-mêmes dans les Annales de physique et de chimie un an plus tard.











