Résumé
Rutherford, né en Nouvelle-Zélande, réalise à Montréal, au début du XXe siècle, une série d'expériences remarquables, dont une partie en collaboration avec Frederick Soddy. Il montre, en partant du thorium, que la radioactivité est la transmutation d'un élément chimique en un autre par émission de rayonnement. Rutherford et Soddy résument en 1903 les conclusions de leurs travaux dans leur article Radioactive Change (La transformation radioactive).
Après son prix Nobel de chimie en 1908, Rutherford découvre à Manchester, en 1911, que l'atome possède un noyau, et observe en 1919 la première réaction nucléaire. Il devient directeur du laboratoire Cavendish à Cambridge ; il compte nombre de prestigieux physiciens et chimistes parmi ses collaborateurs et élèves.


Figure 1 : Ernest Rutherford (1871-1937) (image Fondation Nobel)
De la Nouvelle-Zélande à Montréal par Cambridge
La tombe d'Ernest Rutherford se trouve dans l'abbaye de Westminster, non loin de celle d'Isaac Newton. Pionnier majeur de la science de la radioactivité et de la physique nucléaire, il a été un des grands physiciens de la première moitié du vingtième siècle. Il naquit en 1871 à Spring Grove près de Nelson, sur la côte septentrionale de l'île du Sud de la Nouvelle-Zélande, dans une famille très nombreuse (ils étaient douze enfants). Ses parents étaient d'origine écossaise. Son père eut différentes activités : responsable d'une scierie, fabricant de traverses pour les rails de chemin de fer, cultivateur de lin ; sa mère, institutrice, veillait sur la famille.
La Nouvelle-Zélande du temps de Rutherford
La Nouvelle-Zélande est composée de deux îles montagneuses s'allongeant du Nord au Sud dans l'Océan Pacifique Sud ; l'île du Sud comporte les plus hautes montagnes et des fjords. Ces territoires étaient inhabités lorsque les premiers Maoris venant de Polynésie les abordèrent au IXe ou Xe siècle. Le premier peuplement important par les Maoris se situe au XIIe siècle; ceux-ci s'installèrent alors surtout dans l'île du Nord, y apportant leurs plantes alimentaires et leur mode de vie. Le premier Européen à observer ce pays fut le Hollandais Abel Tasman en 1642. La Nouvelle-Zélande fut "redécouverte" en 1769 par le navigateur anglais James Cook. Les premiers missionnaires arrivent vers 1820 et les premiers colons, notamment écossais, à partir de 1828. La Grande-Bretagne prend officiellement possession des îles en 1840 et en fait une colonie en 1851 ; un "acte constitutionnel" lui est octroyé l'année suivante. À partir de 1858, la Nouvelle-Zélande compte plus d'Européens que de Maoris. Ces derniers se voient dépossédés de leurs terres et de leurs forêts par les colons, ce qui conduit à des guerres de 1842 à 1846 et de 1860 à 1868. Les premiers colons, issus de milieux modestes, ont pourtant un esprit égalitaire, ce qui amène la Nouvelle-Zélande à être le premier pays au monde à donner le droit de vote aux femmes en 1893. La législation sociale sera très en avance sur son temps.
Le jeune Rutherford, très bon élève, obtint des bourses successives pour poursuivre ses études. Il étudia ainsi à l'Université Canterbury de Christchurch alors annexe de celle de Wellington. En 1894 il eut la chance de recevoir une bourse "1851 Exhibition Science Scholarship" pour lui permettre de continuer son travail en Angleterre. On raconte que sa mère lui apporta la nouvelle alors qu'il était en train d'arracher des pommes de terre dans le jardin familial ; il posa alors sa bêche disant: "C'est la dernière pomme de terre que je ramasse". Arrivé à Londres, il reçut une proposition de J.J. Thomson (1856-1940), directeur du laboratoire Cavendish à Cambridge, pour venir y travailler. Dans ce laboratoire, il acheva tout d'abord les recherches qu'il avait commencées en Nouvelle-Zélande sur la réception des ondes radio.
À cette époque J.J. Thomson étudiait l'ionisation des gaz. Ces expériences allaient le conduire en 1897 à la découverte de l'électron, un corpuscule près de 2000 fois plus léger que l'atome d'hydrogène, ce qui lui vaudra le prix Nobel de physique en 1906. Rutherford collabora avec Thomson dans ses recherches sur l'ionisation et se révéla un expérimentateur très adroit, intuitif et fin observateur. En 1898, il obtint la chaire Macdonald de physique à l'Université McGill à Montréal ; le laboratoire qui lui était associé disposait de moyens exceptionnels. Son dernier travail à Cambridge avant de partir au Canada fut l'étude des rayonnements ionisants émis spontanément par l'uranium, découverts à Paris par Henri Becquerel. Il conclut ainsi son étude :
Ces expériences montrent que le rayonnement de l'uranium est complexe et qu'il comporte au moins deux types distincts de rayonnements – l'un qui est très facilement absorbé et que l'on appellera par commodité le rayonnement α, et l'autre de caractère plus pénétrant qui sera appelé le rayonnement β.
Ces dénominations furent assez rapidement acceptées par tous les chercheurs et sont encore utilisées aujourd'hui. Dans son nouveau laboratoire, Rutherford veut poursuivre ses recherches sur la radioactivité (ce nom venait d'être donné au phénomène par Marie Curie) et il se fait expédier à Montréal des sels d'uranium et des sels de thorium
(1).
Un expérimentateur hors du commun
Au cours de l'été de 1899, Rutherford fait à McGill une observation étonnante, dont l’analyse se révélera très fructueuse. Après avoir placé un échantillon radioactif sur le plateau inférieur d'une chambre d'ionisation afin de mesurer le courant d'ionisation créé par la radioactivité, et ainsi mesurer le degré de radioactivité de l'échantillon, il note :
La sensibilité de l'oxyde de thorium à de faibles courants d'air est remarquable. Le mouvement de l'air, provoqué par l'ouverture ou la fermeture d'une porte à l'extrémité de la pièce opposée à l'endroit où est placé l'appareillage, est souvent suffisant pour diminuer considérablement la vitesse de décharge [c'est-à-dire l'intensité du courant d'ionisation]. Quand l'appareillage est placé dans une enceinte fermée, pour supprimer les courants d'air, on trouve que l'intensité est pratiquement constante.
Le physicien en conclut que :
En plus du rayonnement ordinaire, j'ai trouvé que les composés de thorium émettent continûment des particules radioactives d'une certaine sorte, qui conservent leurs propriétés radioactives pendant plusieurs minutes. Cette "émanation", comme nous l'appellerons pour être bref, a le pouvoir d'ioniser le gaz dans son voisinage…
Au cours de ses expériences, Rutherford découvre une autre propriété étonnante de l' « émanation » :
Les ions positifs produits dans un gaz par l'émanation ont le pouvoir de produire de la radioactivité sur toutes les substances sur lesquelles ils tombent… L'émanation des composés de thorium a ainsi des propriétés que le thorium lui-même ne possède pas.
Cette émanation est-elle un gaz, une vapeur, un aérosol ? En novembre, il ajoute, dans un second article sur ce sujet dans Philosophical Magazine (qui paraît en février 1900), que le rayonnement, particulièrement pénétrant, de cette "radioactivité excitée", présente sur tous les corps touchés par l’émanation, voit son intensité diminuer de moitié en onze heures environ, lorsque le corps sur lequel elle apparaît n'est plus en contact avec l'émanation. Il parvient à l'éliminer complètement en frottant vigoureusement la surface du corps avec du papier-émeri ; elle sera par la suite appelée "dépôt actif". Il note, sur les épreuves de son article, que Pierre et Marie Curie viennent d'observer au début de novembre sur des corps placés près de sources de radium une radioactivité qu'ils ont appelée "induite", analogue à la radioactivité excitée qu'il a mise en évidence. Il pense que Pierre Curie arrivera aux mêmes conclusions que lui, mais le physicien français s'attachera pendant quelque temps à une autre interprétation, comme nous le verrons un peu plus loin. Remarquons que Rutherford a le double handicap de disposer de sources bien moins intenses que celles de Paris et de voir les manuscrits de ses articles mettre un certain temps à parvenir à l'éditeur de l'autre côté de l'Atlantique, à Londres. Cependant, en juin 1900, en suivant la même méthode expérimentale que le chercheur de Montréal, un physicien allemand, Ernst Dorn (1848-1916), observe que le radium émet aussi une "émanation" : celle-ci sera appelée "radon" en 1923.
Ayant maintenant à McGill un emploi stable, Rutherford retourne en Nouvelle-Zélande au cours de l'été 1900 pour épouser sa fiancée Mary Newton et l'emmener avec lui au Canada. Au début de 1901, il écrit à sa mère dans leur contrée lointaine : "Je dois continuer à aller de l'avant car il y a toujours des gens sur ma trace. Je dois publier mon travail actuel aussi rapidement que possible pour rester dans la course. Les meilleurs sprinters dans cette voie de recherche sont Becquerel et les Curie à Paris qui ont fait beaucoup de travail très important sur le sujet des corps radioactifs au cours de ces dernières années."
La rencontre avec Soddy
Le 28 mars 1901 a lieu à Montréal un débat passionné entre physiciens et chimistes à la Société de physique locale. Le sujet était L'existence de corps plus petits qu'un atome. Rutherford y expose la découverte, par son maître JJ. Thomson, de l'électron, dont la masse est plus de 1000 fois plus faible que celle de l'atome d'hydrogène ; cependant, face à lui, il trouve un jeune chimiste de talent à l'esprit vif arrivé depuis peu d'Oxford, Frederick Soddy, redoutable dans un débat contradictoire, qui défend l'atome indivisible comme base de la chimie moderne.
Frederick Soddy (1877–1956, prix Nobel 1921) et la notion d’isotopes

De six ans plus jeune que Rutherford, Frederick Soddy est né en 1877 à Eastbourne dans le Sussex. Après ses études à Oxford, suivies de deux années de recherche, il part au Canada et devient préparateur au département de chimie de l'Université McGill. Pendant 18 mois, il travaille avec Rutherford, assurant la chimie de leurs expériences. Ensemble ils découvrent la loi des transformations radioactives. Au printemps 1903 Soddy retourne en Grande-Bretagne et, après un séjour dans le laboratoire de William Ramsay à Londres, devient, de 1904 à 1914, maître de conférences à l'Université de Glasgow. De 1905 à 1921, il écrit, pour la Société chimique de Londres, un rapport annuel sur les nouveaux résultats en radioactivité obtenus l'année précédente. Dans son rapport pour 1910, publié en 1911, il remarque que le nombre de radioéléments qui occupent la dernière partie du tableau de Mendeleïev est trop grand. De plus plusieurs d'entre eux, tels le thorium, le radiothorium et l'ionium, ou le radium D et le plomb, sont chimiquement complètement identiques. On a donc affaire à des atomes du même élément chimique ayant des poids (masses) atomiques différents. Ceci doit se produire aussi pour les éléments qui ne sont pas radioactifs. En 1913, il appellera isotopes ces atomes différents d'un même élément. Il écrit : "L'homogénéité chimique n'est plus une garantie pour qu'un élément supposé ne soit pas un mélange de plusieurs de poids atomiques différents, ou pour qu'un poids atomique ne soit pas simplement un nombre moyen". Cette mise en évidence des isotopes et ses travaux antérieurs vaudront à Soddy, alors professeur à Oxford, le prix Nobel de chimie de 1921.
Dans les semaines qui suivent, Rutherford propose à Soddy de venir travailler avec lui ; il est en effet parvenu à la conviction que seule la coopération d'un chimiste lui permettrait d'élucider la véritable nature de l'émanation du thorium. Ce sera une collaboration particulièrement fructueuse qui durera un an et demi, Soddy effectuant les séparations chimiques et Rutherford réalisant les mesures physiques. Soddy utilise tous les réactifs chimiques possibles pour tenter de décomposer l'émanation ou pour réaliser avec elle des combinaisons chimiques ; sans succès. L'émanation doit donc être un gaz inerte, un nouvel élément, analogue à l'argon découvert par William Ramsay et John Strutt (lord Rayleigh) quelques années auparavant, un membre lourd de la famille des gaz rares, l’homologue supérieur du xénon. Les deux jeunes scientifiques ont alors l'intuition décisive : le thorium, un métal, donne en permanence naissance à un gaz, l’émanation ! On raconte que Soddy dit alors : "C'est une transmutation !" et que Rutherford lui répond: "Tais-toi, on va nous prendre pour des alchimistes!"
ls reprennent leurs recherches. Le thorium est-il bien la véritable source de l’émanation ? Soddy isole du thorium extrêmement pur ; à leur grand étonnement, c'est le précipité dont le thorium a été séparé qui s'avère produire l'émanation et qui contient une grande partie de la radioactivité d'origine attribuée jusque-là au thorium. Un nouveau radioélément accompagne donc le thorium, que Rutherford et Soddy appellent thorium X.
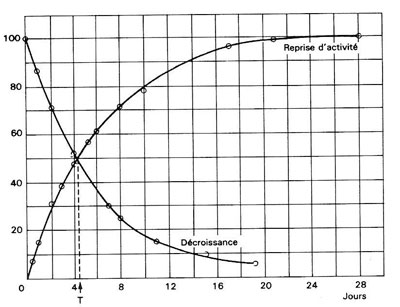
Figure 2:
Décroissance de la radioactivité du thorium X séparé et reprise de la radioactivité de l'échantillon de thorium purifié dans les expériences de Rutherford et Soddy (image extraite de Histoire d’atomes, P. Radvanyi, M. Bordry, Belin 1988, d'après Rutherford et Soddy, Phil. Mag, Sér.6, vol.4, sept. 1902, p.370). T est la période du thorium X (Radium 224) : les mesures récentes donnent 3,63 j pour cette période
(2).
Ils commandent de nouvelles quantités de sels de thorium très pur. Le chimiste et le physicien travaillent en étroite collaboration. Juste avant Noël, Soddy sépare aussi complètement que possible le thorium X. Rutherford est stupéfait lorsqu'il reprend ses mesures de rayonnement au début de janvier 1902 : la radioactivité du thorium X a considérablement décru, alors que le thorium a retrouvé à peu près sa radioactivité d'origine et son pouvoir de produire l'émanation, car il continue à produire du thorium X par transformation radioactive (voir figure 2). Ils apportent ainsi la preuve de ce que le thorium de période de vie extrêmement longue se transmute spontanément en thorium X, et que ce dernier décroît de moitié en un peu moins de 4 jours se transformant en émanation
(3); celle-ci à son tour, avec une période d'environ 1 minute, produit le dépôt actif
(4). Ils montrent de la sorte que la radioactivité est la transformation spontanée d'un élément chimique en un autre par émission de rayonnement. Chacun des éléments de la chaîne (on dira plus tard "famille radioactive") a sa radioactivité particulière, c'est-à-dire possède ses caractéristiques radioactives propres : il décroît exponentiellement avec sa propre période, en émettant un rayonnement spécifique, donnant le radioélément suivant. Il y aura finalement équilibre entre le nombre d'atomes formés et le nombre de ces mêmes atomes qui subissent la désintégration radioactive.
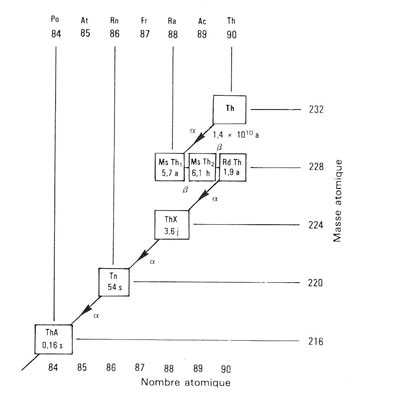
Figure 3 :
La famille du thorium jusqu'au premier radioélément du dépôt actif (thorium A) (5). Chaque radioélément reçut un nom particulier avec une abréviation (qui apparaît dans les petits carrés). Les radioéléments intermédiaires, Rd Th, Ms Th1 et Ms Th2 furent découverts par Otto Hahn en 1905 et 1907. Le début de la famille était alors complet et s'écrivait: Thorium → Mésothorium 1 → Mésothorium 2 → Radiothorium → Thorium X → Thoron (isotope du radon) → Thorium A → ….. Après la découverte de l'isotopie et la compréhension de la signification physique du nombre atomique et du nombre de masse, on écrit aujourd'hui cette succession ainsi: Thorium 232 → Radium 228 → Actinium 228 → Thorium 228 → Radium 224 → Radon 220 → Polonium 216 → …: la dernière partie de la famille, appelée dépôt actif, débute au Polonium 216 et aboutit au Plomb 208 stable; elle n’est pas représentée ici.
Cependant Pierre Curie, poursuivant ses propres expériences, demeure attaché à son interprétation préférée, à l'hypothèse selon laquelle (janvier 1902): "l'atome radioactif est un mécanisme qui puise à chaque instant en dehors de lui-même l'énergie qu'il dégage." En janvier 1903 il écrit : "M. Rutherford semble croire à la nature matérielle de l'émanation". L’accusation allait loin. Rutherford alors se fâche et écrit à la Philosophical Magazine : "M. Curie n'a apparemment pas remarqué l'un de nos derniers articles … dans lequel nous montrons que si nous faisons passer lentement les émanations du thorium ou du radium dans un tube spiralé immergé dans de l'air liquide, les émanations se condensent dans le tube et le gaz qui sort ne présente pas de radioactivité." L'émanation s'est liquéfiée à une certaine température. Elle est donc bien un gaz : la preuve est irréfutable. P. Curie répète cette expérience et est convaincu ; il se ralliera alors à la manière de voir de Rutherford et Soddy et adoptera leurs conclusions.
« Radioactive change » : la transformation radioactive
En mai 1903, Rutherford et Soddy publient dans
Philosophical Magazine un grand article de synthèse résumant leurs résultats et leurs conclusions
(6). Ils écrivent :
Dans des articles antérieurs, il a été montré que la radioactivité des éléments radium, thorium et uranium est maintenue par la production continue de nouvelles sortes de matière possédant une activité temporaire (…) Ces différents nouveaux corps se distinguent donc de la matière ordinaire sur seulement un point, qui est que leur quantité est bien inférieure à la limite atteignable par les méthodes ordinaires d'analyse chimique et spectroscopique. Pour présenter un exemple de ce que ceci n’est pas un argument contre leur existence matérielle spécifique, on peut mentionner que c’est encore vrai pour le radium lui-même sous sa forme native (…) et les résultats tendent à prouver que le radium est en réalité un des éléments chimiques les mieux définis et les plus caractéristiques. (…)
Ils doivent maintenant examiner la nature des transformations qui produisent ces nouveaux corps :
(…) Lorsque plusieurs transformations ont lieu ensemble, elles ne sont pas simultanées, mais successives. Ainsi, le thorium produit le thorium X, le thorium X produit l’émanation de thorium, et cette dernière produit l’activité excitée. Mais on peut montrer que la radioactivité de chacune de ces substances est liée, non pas à la transformation par laquelle elle a été produite, mais à la transformation au cours de laquelle elle produit à son tour le nouveau type suivant. Ainsi, après que le thorium X a été séparé du thorium qui le produit, son rayonnement est proportionnel à la quantité d’émanation qu’il produit, et à la fois la radioactivité et le pouvoir d’émanation du thorium X décroissent suivant la même loi et au même taux.
Leur conclusion à ce stade est claire :
Il n'est donc pas possible de considérer la radioactivité comme une conséquence de transformations qui ont déjà eu lieu. Les rayons émis accompagnent nécessairement la transformation du système qui rayonne en celui qui le suit.
@@@@@@@
Les deux scientifiques examinent ensuite la nature matérielle du rayonnement, des rayons bêta, électrons chargés négativement, et des rayons alpha, chargés positivement, et dont la masse est plus de mille fois plus élevée que celle des électrons (ceci en supposant que la valeur de leur charge est la même):
(…) les rayons [α] sont donc constitués de corps chargés positivement projetés à grande vitesse (…) La valeur de e/m, rapport de la charge du porteur à sa masse, est de l’ordre de 6.10
3 (…) Or e/m = 10
4 pour l’atome d’hydrogène lors de l’électrolyse de l’eau. La particule qui constitue les rayons α se comporte donc comme si sa masse était du même ordre que celle de l’atome d’hydrogène
(7).
Rutherford et Soddy notent en bas de page l’existence d’un autre type de rayons, en plus des rayons α et β, en remarquant que les trois corps radioactifs naturels alors connus (radium, thorium et uranium) émettent cet autre type de rayons. Ceux-ci, un rayonnement électromagnétique de grande énergie (donc sans charge), ont été découverts en 1900 par le physicien français Paul Villard (1860-1934); ils furent appelés par la suite rayons γ ; ils ne correspondent pas à une transformation de l'élément chimique.
Une conséquence de cette analyse leur semble évidente :
À la lumière de ces preuves, il y a toute raison de supposer non seulement que l'expulsion d'une particule chargée accompagne la transformation, mais que cette expulsion est en fait la transformation.
@@@@@@@
Ils exposent ensuite la loi des transformations radioactives qu'ils ont établie. La décroissance radioactive est exponentielle. Si N0 est le nombre d'atomes radioactifs initialement présents, et Nt le nombre d'atomes qui sont encore inchangés au temps t, on peut écrire : Nt/N0 = e-λt. Il s'ensuit que
le taux de transformation du système est à tout instant proportionnel à la quantité qui n'a pas encore été transformée.
Cette proportionnalité est donnée par dNt/dt = - λNt. La loi peut donc s'énoncer
la proportion de matière radioactive qui se transforme par unité de temps est une constante. λ est appelée la "constante radioactive".
La période
(8) T est liée à cette constante par la relation : T = 0,693/λ. Ils donnent une des conséquences expérimentales de la loi :
La complexité du phénomène de radioactivité est due à l’existence, en général, de différents types de matière se transformant simultanément l’un en l’autre, chaque type possédant une constante radioactive différente.
Ils expliquent et soulignent :
Au vu des connaissances actuelles, la radioactivité doit être considérée comme le résultat d’un processus qui se situe entièrement hors de la sphère des forces contrôlables connues, et ne peut être ni créée, ni altérée, ni détruite. (…) Il n'y a plus aucun doute sur l'affirmation originale de Mme Curie, selon laquelle la radioactivité est une propriété spécifique de l'élément. (…) Il sera montré plus loin qu'une transformation radioactive ne peut correspondre qu’à une désintégration atomique.
@@@@@@@
Les auteurs poursuivent leur analyse des transformations radioactives :
S'il existe des éléments plus lourds que l'uranium, il est probable qu'ils seront radioactifs. L’extrême sensibilité de la radioactivité en tant que moyen d’analyse chimique permettrait la reconnaissance de tels éléments, même s’ils étaient présents en quantité infinitésimale. (…) La transformation radioactive doit être telle qu’elle implique un seul système, car s’il s’y déroulait une combinaison où interviendrait l’action mutuelle de deux systèmes, le taux de transformation dépendrait de la concentration (…) Ceci n’est pas le cas.
Ils en déduisent logiquement :
Puisque la radioactivité est une propriété spécifique de l’élément, le système subissant la transformation doit être l’atome chimique (…) dans la transformation radioactive, l'atome chimique doit subir une désintégration. Parmi tous les éléments, les radioéléments sont ceux qui possèdent le poids atomique le plus élevé. C'est de fait leur unique caractéristique chimique commune. La désintégration de l'atome et l'expulsion de particules lourdes chargées (…) conduisent à un nouveau système, plus léger, dont les propriétés physiques et chimiques sont totalement différentes de celles de l'élément originel.
@@@@@@@
Rutherford et Soddy établissent ensuite pour la première fois l'existence de
familles radioactives comportant chacune une suite de radioéléments se désintégrant les uns dans les autres
(9). C'est là un pas-de-géant pour la science de la radioactivité. Ils pensent reconnaître trois familles, dont ils donnent une ébauche, celles de l'uranium, du thorium et du radium; les points d'interrogation dans le tableau (voir figure 4 ci-dessous) représentent les produits ultimes des familles, alors inconnus. Les taux de désintégration du thorium et de l'uranium sont tellement lents à l'échelle géologique qu’on en retrouve de nos jours des quantités importantes. Ce taux paraît être environ un million de fois plus rapide pour le radium ; la période de celui-ci ne pourrait pas alors être supérieure à quelques milliers d'années; le radium leur semble donc provenir par désintégrations successives d'un autre élément à vie très longue présent dans le minéral :
(…) le radium présent dans un minéral n'a pas eu une existence aussi longue que le minéral lui-même, mais est continuellement produit par transformation radioactive.

Figure 4 (ci-dessus) :
Dans l’article de 1903 de Rutherford et Soddy, se trouve la première esquisse des suites de désintégrations radioactives – plus tard appelées « familles radioactives ». On trouve dans la Nature trois familles d’éléments radioactifs lourds, issues de radioéléments de très longue période et aboutissant toutes les trois à des isotopes stables du plomb. Ces familles sont celles de l'Uranium 238/Radium, du Thorium, et de l'Uranium 235/Actinium
(10). Une quatrième famille, celle du Neptunium 237, est constituée uniquement de radioéléments artificiels et aboutit au bismuth. Il ne peut exister que quatre familles de ce type.
De fait, il sera montré par la suite que la famille du radium, telle qu'elle est esquissée ci-dessus par Rutherford et Soddy, fait partie de celle de l'uranium (on dit aujourd'hui : de l'uranium 238/radium). La famille du thorium sera complétée. On mettra aussi en évidence la famille de l'actinium descendant de l'uranium 235 (autre radioélément naturel de très longue période), et, dans les années quarante, celle du neptunium 237 (le neptunium sera le premier élément transuranien "artificiel" créé par l'homme
(11). Les "radioéléments naturels" sont les radioéléments à vie très longue qui subsistent depuis la formation de la Terre, accompagnés des radioéléments à vie plus courte qui proviennent de leur désintégration (certains radioéléments naturels, tel le potassium 40, ne font toutefois pas partie des quatre familles qui occupent elles la dernière partie du tableau de Mendeleïev, celle des éléments lourds).
@@@@@@@
Les auteurs calculent ensuite, sur la base de leurs expériences, l'énergie libérée par la désintégration de 1 gramme de radium, et la comparent à celle libérée par une transformation chimique produisant beaucoup d’énergie comme l'union de l'hydrogène et de l'oxygène pour donner 1 gramme d'eau. Considérant que chaque désintégration d'un atome de radium produit au moins une particule (et davantage si l'on tient compte des filiations successives), ayant mesuré l'énergie cinétique d'une telle particule, estimant le nombre d'atomes par gramme de radium, Rutherford et Soddy obtiennent une valeur minimum de l'énergie libérée par la transformation radioactive de tous les atomes d'un gramme de radium. L'énergie libérée par la synthèse d'un gramme d'eau est connue. Ils en concluent ainsi que :
L'énergie de la transformation radioactive doit donc être au moins vingt mille fois, et peut-être un million de fois, plus grande que l'énergie de n'importe quelle transformation moléculaire
D'autre part:
(…) l'énergie totale de la transformation radioactive (…) ne peut constituer qu'une partie de l'énergie interne de l'atome, car l'énergie interne des produits résultants reste inconnue. Toutes ces considérations conduisent à la conclusion que l'énergie latente dans l'atome doit être énorme en comparaison avec celle qui est libérée dans les transformations chimiques ordinaires. Cependant, les radioéléments ne diffèrent en aucune manière des autres éléments dans leur comportement chimique et physique (…) Il n'y a donc aucune raison de supposer que seuls les radioéléments possèdent cette énorme réserve d'énergie…
Rutherford et Soddy concluent :
L'existence de cette énergie rend compte de la stabilité des éléments chimiques… Elle doit être prise en compte en physique cosmique. L'entretien de l'énergie solaire, par exemple, ne présente plus aucune difficulté fondamentale si l'énergie interne de ses constituants est considérée comme disponible, c'est-à-dire si des processus de transformation subatomique ont lieu.
Ces prévisions sont remarquables. La loi des transformations radioactives apporte clarté et ordre dans le domaine de la radioactivité. Soddy au printemps 1903 retourne en Angleterre. Rutherford poursuit ses recherches au Canada jusqu'en 1907, quand il devient professeur à l'Université de Manchester. Le jeune radiochimiste Otto Hahn (1879-1968), futur prix Nobel, qui venait de mettre en évidence un nouveau radioélément, le radiothorium (thorium 228), avait passé une année auprès de lui à Montréal.
La suite du programme
La question de la nature des produits ultimes des familles radioactives était maintenant posée. Déjà en 1902, Rutherford et Soddy avaient écrit : "On peut naturellement conjecturer que la présence d'hélium dans les minéraux et son invariable association avec l'uranium et le thorium sont liées à leur radioactivité." Si l'hélium est un produit ultime de désintégration, il serait possible que la particule alpha elle-même soit un atome d'hélium. Dès 1903, utilisant une très forte source de bromure de radium, Soddy et Ramsay, dans le laboratoire de ce dernier à Londres, mirent effectivement en évidence la présence d'hélium dans le radium et dans l'émanation (radon) grâce à son spectre optique.
La datation géologique de l’américain Boltwood, sur une idée de Rutherford
Dans une conférence prononcée à Saint-Louis aux Etats-Unis en septembre 1904, Rutherford propose d'utiliser la teneur en hélium des minéraux uranifères pour déterminer l'âge minimum de ces roches, âge minimum car l'hélium occlus peut s'en échapper (12). Le physicien américain Bertram B. Boltwood (1870-1927), professeur à l'Université Yale, est un grand admirateur de Rutherford avec lequel il échangera une abondante correspondance et dont il deviendra l'ami. Boltwood pendant quelques années est co-directeur d'un laboratoire privé d'ingénierie des mines. Il vérifie la suggestion de Rutherford en faisant des mesures sur des roches de différents âges. Il montre que le radium est un produit de la désintégration de l'uranium, car le radium et son émanation apparaissent toujours dans les mêmes proportions par rapport à l'uranium dans les minéraux uranifères. Il découvre en 1907 le radioélément manquant intermédiaire, qui fut appelé "ionium" (le thorium 230), le parent immédiat de très longue période du radium. Trouvant du plomb dans tous les minéraux contenant de l'uranium, Boltwood est le premier à penser que le plomb est le produit final de la suite des désintégrations radioactives. De plus, la proportion de plomb est d'autant plus importante que le minéral est plus ancien du point de vue géologique. Il met ainsi au point, en 1905-1907, une nouvelle méthode de mesure de l'âge des roches qui, pour les plus anciennes, se chiffre en milliards d'années. Il s’agit d’une des premières méthodes rigoureuses de datation géologique, précédant la méthode au carbone 14 de William Libby, mise au point dans les années 1940 ; cette dernière fait aussi appel à la radioactivité résiduelle, mais est utilisée pour des datations plus récentes (quelques milliers d’années).
Rutherford avait déjà entrepris d'examiner de plus près la nature du rayonnement le plus énergique émis par les radioéléments, c'est-à-dire des particules alpha. Cette quête va le conduire vers de nouvelles découvertes. Une première expérience ingénieuse lui avait permis de montrer qu'il s'agissait là de particules de charge positive, dont la masse était de l'ordre de grandeur de celle de l'atome d'hydrogène. Des mesures plus précises lui donnent le rapport de la charge à la masse des particules alpha. Il soupçonne alors que ces particules sont des atomes d'hélium portant une double charge, mais il fallait le prouver.
Dans son nouveau laboratoire de Manchester, Rutherford accueille de jeunes chercheurs; parmi ceux-ci se trouve le physicien allemand Hans Geiger (1882-1945), arrivé déjà à Manchester en 1906 après avoir soutenu sa thèse à Erlangen sur la décharge électrique dans les gaz. Rutherford et Geiger développent un appareil, l'ancêtre du fameux compteur Geiger, leur permettant de détecter les particules alpha une à une, et de mesurer ainsi leur nombre émis par seconde par une quantité donnée de radium. Ils vérifient leur résultat à l'aide de la méthode des scintillations, mise au point indépendamment. La détermination de la charge positive totale emportée par l'ensemble des particules alpha leur permet de conclure en 1908, que ces particules sont bien des atomes d'hélium, émis à grande vitesse, portant deux unités de charge électrique.
En décembre 1908 Rutherford reçoit le prix Nobel de chimie "pour ses recherches sur la désintégration des éléments et la chimie des substances radioactives". En conclusion de son discours de présentation, le président de l'Académie royale des sciences de Suède souligne :
La théorie de la désintégration et les résultats expérimentaux sur lesquels elle s'appuie sont synonymes d'une nouvelle orientation en chimie, impliquant une compréhension neuve et résolument plus étendue des bases mêmes de cette science. Pour les chimistes du XIXe siècle, l'atome et l'élément chimique représentaient les limites ultimes que l'on pouvait atteindre par décomposition chimique et fixaient ainsi la limite de la recherche expérimentale. Savoir ce qui pouvait exister au delà n'était qu'un sujet de spéculations plus ou moins vagues et stériles. Cette frontière, pendant longtemps infranchissable, a maintenant été balayée…
L'atome possède un noyau, et les rayons X permettent de le découvrir !
Rutherford est maintenant sûr de la nature des particules alpha. Il veut alors connaître les propriétés de ces particules de grande vitesse lorsqu'elles traversent la matière. Il demande donc en 1909 à son collaborateur Hans Geiger et à un étudiant anglais, Ernest Marsden (1889-1970), récemment arrivé dans son laboratoire, d'étudier la diffusion des particules alpha à travers de minces feuilles métalliques, et notamment de feuilles d'or; les jeunes physiciens utilisent une forte source de radon et la méthode des scintillations pour compter les alphas. Geiger et Marsden lui montrent alors un résultat surprenant qu'ils ne parviennent pas à expliquer. La plupart des particules traversent les feuilles, déviées simplement d'un petit angle par rapport à la direction initiale ; mais sur une feuille d'or, quelques-unes sont déviées de plus de 90°, revenant donc en arrière. Rutherford décrira ainsi son étonnement : "C'était comme si vous aviez tiré un obus de 15 pouces sur une feuille de papier de soie et qu'il ait rebondi et vous ait atteint." Il va réfléchir pendant un an et demi pour comprendre, en suivant même un cours de statistique.
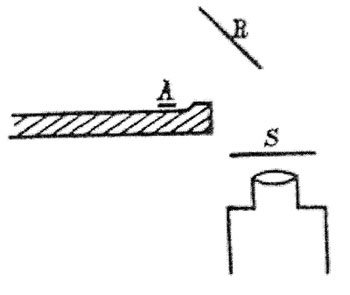
Figure 5 : Schéma d'une des expériences de Geiger et Marsden (1909). La source radioactive de particules α est en A, une feuille de platine est en R, S est l’écran à scintillations vu à travers le microscope : les physiciens observent que certaines particules α reviennent vers l'arrière (H. Geiger et E. Marsden, Proc. Royal Soc. 1909 A, vol. 82, p. 495).
Figure 5Bis : (ci-dessous) Schématisation actuelle de l’expérience de Geiger et Marsden. A gauche, le dispositif utilisé : on voit certaines particules alpha revenir en arrière. A droite, l’explication par la présence des noyaux au centre des atomes.
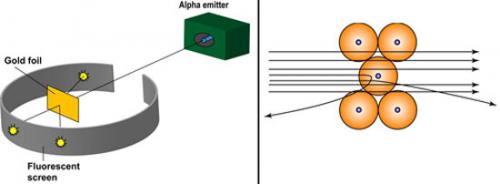
En décembre 1910, Rutherford dit enfin à Geiger : "Je sais maintenant à quoi ressemble un atome !" Son article de base paraît dans Philosophical Magazine en mai 1911. Il conclut que, si la particule alpha passe près du centre d'un atome, sa trajectoire, sous l'effet d'une force répulsive variant en raison inverse du carré de la distance, sera une hyperbole, et que l'atome contient une charge centrale distribuée dans un tout petit volume; les grandes déflexions sont dues à la totalité de la charge centrale. L'année suivante il appellera noyau cette région centrale de l'atome où sont concentrés sa charge positive et l'essentiel de sa masse. Geiger et Marsden confirmeront par de nouvelles expériences les prévisions quantitatives de l'analyse théorique de Rutherford.
Les contemporains saisissent immédiatement l'importance et les conséquences de cette découverte. Un avocat hollandais en affaires immobilières, physicien amateur remarquable, Antonius J. van den Broek (1870-1926), propose en 1911 et 1913, dans deux lettres à la revue Nature, que : "Le nombre d'éléments chimiques possibles est égal au nombre de charges permanentes possibles de chaque signe par atome, ou, en d'autres termes, à chaque charge permanente possible (de l'un ou de l'autre signe) par atome correspond un élément possible." Il ajoute : "Si l'on range tous les éléments par poids atomiques croissants, le numéro d'ordre de chaque élément dans la classification doit être égal à sa charge intra-atomique." Un jeune collaborateur de Rutherford, Henry G. J. Moseley (1887-1915), se met aussitôt en devoir de vérifier expérimentalement la proposition de van den Broek. Utilisant la nouvelle méthode de Bragg de spectroscopie des raies X par réflexion sur un cristal, il fait "l'appel" des éléments (il en trouve 92 jusqu'à l'uranium), et confirme, en 1913-1914, les suggestions du physicien amateur hollandais. Le numéro d'ordre de la classification périodique de Mendeleïev a désormais une signification physique.
@@@@@@@
Au début de 1912, un jeune physicien théoricien danois, Niels Bohr (1883-1962), après avoir soutenu sa thèse à Copenhague, décide de faire un séjour scientifique en Grande-Bretagne. Il se rend d'abord à Cambridge chez J.J. Thomson. Cependant, ayant appris la découverte du noyau de l'atome par Rutherford, il vient travailler auprès de lui à l'Université de Manchester. Là, il commencera à élaborer son premier modèle de l'atome, s'appuyant sur la nouvelle description de Rutherford et la quantification à l'échelle microscopique introduite par le physicien allemand Max Planck. Ce sera l'atome de Bohr (prix Nobel de physique de 1922).
Un chimiste hongrois, après des études en Allemagne et un poste d'assistant à Zurich, Georg de Hevesy (1885-1966), rejoint en 1910 le laboratoire de Rutherford. Celui-ci lui propose de tenter de séparer le radium D du plomb. N'y parvenant pas (le radium D sera reconnu comme un isotope du plomb), Hevesy a dans le train entre Vienne et Budapest l'idée d'utiliser cette propriété pour faire du radium D le premier indicateur radioactif (1913); il réalise la première expérience de ce type peu après avec le physicien et chimiste autrichien Friedrich Paneth. Le grand succès des indicateurs radioactifs sera obtenu par Hevesy avec les radioéléments artificiels et lui vaudra le prix Nobel de chimie de 1943.
Un autre jeune physicien arrivé en 1911 au laboratoire de Rutherford pour achever ses études est James Chadwick (1891-1974) qui reçoit en 1913 une bourse pour poursuivre ses recherches à l'étranger. Il choisit d'aller travailler à Berlin dans le laboratoire dont Hans Geiger vient d'être nommé directeur. En ce lieu, il étudie les rayons β émis par les corps radioactifs, censés alors être tous des électrons mono énergétiques, comme le sont les alphas. Mais Chadwick observe, en utilisant la technique des compteurs, que la majorité des électrons forment des spectres continus (spectres bêta). Pendant toute la guerre de 1914-1918, Chadwick, citoyen britannique, est interné dans le camp de prisonniers civils de Ruhleben. Il y fait la connaissance d'un autre interné, Charles D. Ellis, qui rêve de devenir officier d'artillerie après la guerre. Chadwick le convainc de devenir physicien et d'aller comme lui travailler avec Rutherford après la fin du conflit. Ellis sera alors le premier à mettre en évidence l'existence de niveaux d'excitation du noyau.
Les débuts de la « physique nucléaire »
En 1919, encore à Manchester, Rutherford fait une expérience toute simple qui ouvrira une voie nouvelle à la science de la radioactivité. Dans une petite chambre (une boîte parallélépipédique), fermée par un écran scintillant, il place une forte source radioactive émettrice de rayons alpha énergiques. Il remplit la chambre d'azote. Lorsque la source est suffisamment éloignée de l'écran, les alpha ne peuvent plus l'atteindre, et pourtant Rutherford continue à observer des impacts provoquant des scintillations. Ce phénomène ne se produit pas lorsque la chambre est remplie d'oxygène ou de gaz carbonique. Il constate qu'il s'agit de protons (noyaux d'hydrogène) et conclut que quelques particules alpha ont désintégré des noyaux d'azote.
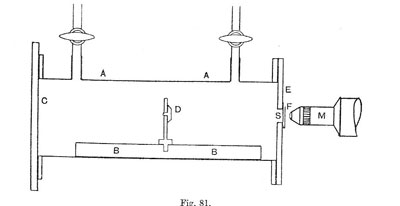
Figure 6 : Observation de la première réaction nucléaire. Une source de radium est placée en D, un écran scintillant au sulfure de zinc en F, la chambre est fermée par une mince feuille d'argent S (Rutherford, Phil. Mag. 1919, vol. 37, p. 581 et Rutherford, Chadwick & Ellis, Radiations from Radioactive substances, Cambridge University Press, 1930).
C'est la première transmutation provoquée, la première réaction nucléaire, le début de la physique nucléaire. En 1924, son collaborateur Patrick M. S. Blackett (1897-1974), prix Nobel de physique 1948, montrera, sur des clichés de chambre à brouillard, que la réaction sur l'azote produit de l'oxygène :
azote 14 + alpha → oxygène 17 + proton.
@@@@@@@
À la fin de 1919, Rutherford reçoit la direction du laboratoire Cavendish à Cambridge, prenant la suite de celui qui avait été son maître, J.J. Thomson. À Cambridge il accueille notamment le jeune physicien soviétique Piotr L. Kapitsa (1894-1984), également futur prix Nobel (1978), qu'il aidera à obtenir son propre laboratoire de physique des très basses températures. Deux autres jeunes physiciens, Edward V. Appleton et Cecil F. Powell, qui recevront aussi le prix Nobel pour leurs découvertes ultérieures, font leurs premières recherches dans le laboratoire de Rutherford.
Rutherford s'intéresse très tôt à la réalisation d'accélérateurs de particules: il doit être possible ainsi de disposer de faisceaux de particules plus intenses que ceux des sources radioactives, bien définis en direction et sans doute aussi d'énergies plus élevées. Il demande notamment au jeune physicien irlandais, Ernest T.S. Walton (1903-1995), d'étudier des dispositifs à cette fin. En janvier 1929, le physicien d'origine russe George Gamow (1904-1968) vient à Cambridge pour exposer sa théorie de la radioactivité alpha qu'il avait élaboré à Göttingen à l'aide de la toute nouvelle mécanique quantique. Selon cette théorie les particules alpha ont une certaine probabilité de sortir du noyau en traversant la "barrière de potentiel" qui l'entoure par
effet tunnel (13). Le physicien John D. Cockcroft (1897-1967) assiste à la conférence de Gamow et se rend compte immédiatement que l'on peut appliquer la théorie dans l'autre sens, et prévoir ainsi qu'une particule accélérée venant de l'extérieur peut pénétrer dans le noyau plus facilement qu'on ne l'avait imaginé. Il va aussitôt voir Rutherford qui le charge de construire avec Walton le petit accélérateur haute tension nécessaire. On envisage de produire des protons de 700 kilovolts; le faisceau est vertical et tombe sur une cible très mince de lithium. Une fois à 400 kilovolts, Watson va voir – à travers un petit microscope – l'écran à scintillations placé sous l'installation. Il observe les premières scintillations; avec Cockcroft ils appellent Rutherford qui vient voir à son tour. Celui-ci s'exclame : "
Ces scintillations ressemblent diablement à celles d'une particule alpha, et je devrais être capable de reconnaître une scintillation de particule alpha quand j'en vois une: j'étais là, lors de la naissance de la particule alpha et depuis lors je n'ai cessé d'en observer." Les deux jeunes physiciens observent alors les deux alpha émis en coïncidence dos-à-dos dans la réaction : proton + lithium 7 → alpha + alpha . C'est la première réaction nucléaire provoquée par des particules accélérées artificiellement. Elle vaudra à Cockcroft et Walton le prix Nobel de physique de 1951.
Au début de 1932, partant d'observations faites un mois plus tôt à l'Institut du Radium de Paris par Frédéric et Irène Joliot-Curie, et s'appuyant sur une suggestion faite douze ans plus tôt par Rutherford, James Chadwick, dont nous avons parlé plus haut, découvre le neutron, qui est avec le proton un des constituants du noyau de l'atome (comme le montrera peu après le physicien allemand Werner Heisenberg). Chadwick recevra le prix Nobel de physique de 1935.
Rutherford avait été fait Lord en 1931. Il mourut à la suite d'une intervention chirurgicale en octobre 1937. Ce grand savant a marqué de son empreinte un grand nombre de scientifiques à travers le monde, apportant constamment des idées nouvelles à ses collaborateurs; son sens de l'observation et son intuition étaient incomparables.
Mai 2010

(1) Métal relativement abondant, découvert dans des minerais de Norvège en 1828 (d’où sa désignation issue du dieu de la mythologie norvégienne Thor). Sa radioactivité avait été mise en évidence indépendamment par Gerhardt Schmidt en Allemagne et par Marie Curie en France.
(2) Après une période T, les deux courbes se croisent car l'activité du thorium X séparé a décru de moitié, tandis que le thorium X continuellement formé dans l'échantillon de thorium purifié est revenu à la moitié de sa valeur d'équilibre. La somme des deux est en apparence constante, car le thorium a une période extrêmement longue (la décroissance de son activité n’apparaît pas sur une échelle de 28 jours).
(3) L'intervalle de temps au bout duquel la quantité d'un radioélément donné et l'intensité de son rayonnement ont diminué de moitié sera appelé "période". Au bout d'une période, il ne subsiste que la moitié de la radioactivité initiale, au bout de deux périodes, il n'en subsiste plus que le quart, etc.
(4) Le dépôt actif était en fait une succession de radioéléments, dont le premier, à partir de l'émanation du thorium, fut appelé thorium A (polonium 216).
(5) Au moment de la rédaction de leur article, Rutherford & Soddy ne « voient » que l’émanation et ce qu’ils appellent le « thorium X ». L’émanation s’avérera être le radon 220, le Thorium X s’avérera être le Radium 224. Les trois radioéléments intermédiaires, le Radium 228 émetteur β, l'Actinium 228 émetteur β, et le Thorium 228 émetteur α, n'avaient pas encore été mis en évidence. Ces derniers sont des isotopes radioactifs du Thorium de nombre de masse (ou "masse atomique") 232, du Radium de nombre de masse 226 découvert par les Curie en 1898 à partir du minerai d’uranium, de l’Actinium de nombre de masse 227 découvert par Debierne en 1899.
(6) C’est le texte présenté ici dans BibNum.
(7) Rutherford et Soddy obtiennent donc à peu près 0,6 pour le rapport e/m de la particule α divisé par le rapport e/m de l’ion hydrogène. Ceci était un bon ordre de grandeur pour cette grandeur qui vaut approximativement 0,5.
(8) Rappelons que l’on entend par période T la « demi-vie » radioactive : en un temps T, la population d'atomes radioactifs est divisée par 2. On a donc e-λT = 1/2, soit T = 0,693/λ.
(9) Dans cet article, ils appellent "métabolons" les radioéléments à vie courte qu'ils ont mis en évidence. Cette appellation sera abandonnée par la suite.
(10) Sur la figure 4, seules deux de ces trois familles actuelles apparaissent : la famille au centre correspond à celle du thorium ; la famille de droite viendra, par la suite, en prolongement de la famille de gauche, correspondant à la famille de l’uranium 238/radium.
(11) L’ensemble de la famille radioactive du neptunium est composé de radioéléments artificiels. Les trois autres familles radioactives (uranium 235, uranium 238/radium, et thorium) sont issues de radioéléments naturels.
(12) Cette intuition était déjà en germe dans l’article de 1903 analysé ici, dans le quel on peut lire : « Dans les minéraux sous forme naturelle contenant les radioéléments, ces transformations [radioactives] doivent avoir lieu continuellement pendant de très longues périodes et, à moins qu’ils réussissent à s’échapper, les produits ultimes devraient s’être accumulés en quantité suffisante pour être détectés, et devraient donc apparaître dans la nature comme les compagnons invariables des radioéléments ».
(13) Il s’agit du premier résultat de mécanique quantique effectivement utilisé en physique nucléaire : on considère que c’est à ce moment-là que ces deux disciplines effectuent une « jonction ».






















