La dissymétrie moléculaire
- INFORMATION
- ACTUALITÉ
- ANALYSE
- EN SAVOIR PLUS
- À TÉLÉCHARGER
« Recherches sur les relations qui peuvent exister entre la forme cristalline, la composition chimique et le sens de la polarisation rotatoire », Annales de chimie et de physique, 3° série, XXIV (1848), p. 442-459 [repris dans Œuvres de Louis Pasteur tome 1 Dissymétrie moléculaire, Masson 1922, p. 65 et ss, ici reproduit]. Texte complémentaire : « La dissymétrie moléculaire », conférence faite à la Société chimique de Paris le 22 décembre 1883 [repris dans Œuvres de Louis Pasteur, tome 1 Dissymétrie moléculaire, Masson 1922, p. 369 et ss, ici reproduit].
1848
Pasteur étudie les acides tartriques (fermentation du vin) et décèle les deux formes chirales, la forme lévogyre et la forme dextrogyre – et la neutralité optique du mélange des deux composants. L’analyse de la dissymétrie moléculaire (dont il est un des pionniers) est un élément de recherche important dans la biochimie actuelle et la compréhension des formes de vie.

Pasteur étudie les acides tartriques (fermentation du vin) et décèle les deux formes chirales, la forme lévogyre et la forme dextrogyre ; il explique ainsi – ce qui n’était pas compris – la neutralité optique du mélange des deux composants. Pasteur, en fixant les bases de la chiralité moléculaire a inauguré une des premières découvertes fondamentales de la chimie et de la biologie. Depuis ces travaux de pionnier, la chiralité est devenue centrale dans les sciences de la matière. Ses applications sont innombrables, allant de la synthèse des molécules actives aux propriétés des constituants intervenant dans l’imagerie. Il convient d’ajouter une science récente, l’astrochimie, où la recherche de précurseurs chiraux des molécules terrestres est plus que jamais d’actualité. La grande question posée est en effet : par quel mécanisme la nature a-t-elle sélectionné une seule des formes énantiomères des sucres et acides aminés dont nous sommes constitués ?

Pasteur studied tartaric acids (wine fermentation) and discovered the two chiral forms, the levorotatory form and the dextrorotatory form; he thus explains – which has not been included – the optical neutrality of mixing two components. By laying the foundations of molecular chirality, Pasteur unveiled one of the first main discoveries in chemistry and biology. Since this pioneering work, chirality has been central to material sciences. Its applications are numerous, ranging from the synthesis of active molecules to the properties of components involved in imaging. Also worth mentioning is the recent science, astrochemistry, where research of chiral precursors of terrestrial molecules is more relevant than ever. The big question is this: in what way has nature chosen a single enantiomeric form of sugars and amino acids from which we are made?
Alain Sevin est directeur de recherches émérite au CNRS (il a dirigé le laboratoire de chimie théorique de l'université Pierre et Marie Curie à Paris) ; il est ancien enseignant à l'École polytechnique et à l'École nationale des techniques avancées. Ingénieur de l'École Nationale Supérieure de Chimie de Paris (1963), il commence sa carrière scientifique dans le domaine de la chimie organique après sa thèse de doctorat (1968). Il est l’auteur d'une centaine d'articles dans les revues majeures et de plusieurs traités de chimie organométallique et de chimie théorique.


- - Augustin Fresnel (1788-1827). Il est le premier à créer une lumière polarisée circulairement, et il propose une construction vectorielle simple de la lumière polarisée plane (6).
- - Jean-Baptiste Biot (1777-1862). Il développe et utilise vers 1815 le saccharimètre qui utilise la déviation du plan de polarisation de la lumière pour étudier et doser des solutions de sucres. Il établit la loi simple :
α = [α0]T, λl c
où α, mesuré en degrés, est la déviation observée du plan de la lumière, [α0] est la déviation spécifique du composé étudié, l la longueur en dm de la cuve traversée par la lumière, contenant l’échantillon en solution et c sa concentration en g mL-1. [α0] est défini à température T et longueur d’onde λ données, la nature du solvant étant également précisée.
Louis Pasteur (1822-1895), chimiste actif dès les années 1840
Sa découverte du vaccin antirabique (1885) vaut à Louis Pasteur sa grande renommée dans un large public. Cette popularité associe dans l’imaginaire national Pasteur à la IIIe République et à la science triomphante portée par cette époque – jusqu’à la Première Guerre mondiale. Or, Pasteur a eu une carrière scientifique active dès les années 1840 (sous Louis-Philippe). Il entre à l’École normale supérieure en 1843 et passe sa thèse en 1847. Le premier texte analysé ici, sur la chiralité moléculaire, date de mai 1848 : ces travaux vaudront à Pasteur la très prestigieuse médaille Rumford de la Royal Society dès 1856.

Une autre image solidement liée à Pasteur est celle de la microbiologie, et de la découverte des microbes. On oublie que s’il a en effet créé cette nouvelle science, il était à l’origine, par sa formation et sa pratique, chimiste – d’où ses travaux sur la polarité des molécules. Il était l’élève du physicien Jean-Baptiste Biot (1774-1862).
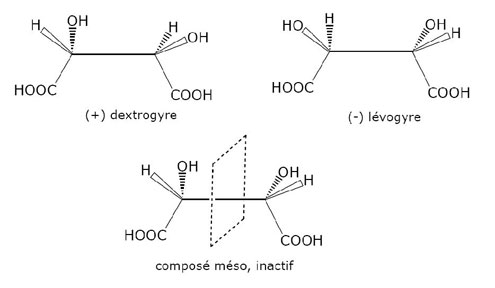

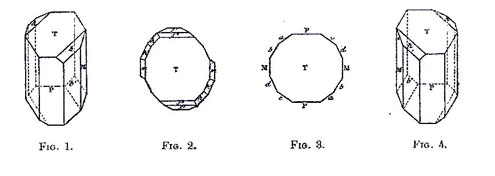
- - des espèces cristallines énantiomères correspondent à des molécules possédant les mêmes propriétés physiques et ne différant que par la configuration spatiale absolue de leurs constituants. Cette disposition entraîne pour chaque énantiomère un comportement différent vis-à-vis de la lumière polarisée ;
- - le mélange en quantité égale des ces deux formes conduit à une neutralisation des propriétés vis-à-vis de la lumière polarisée plane ;
- - si un composé possède un plan de symétrie moléculaire, il est superposable à son image et inactif en lumière polarisée.
Explication de la découverte de Pasteur
Utilisons le résultat fondamental de Le Bel et van t’Hoff. Un atome de carbone possédant quatre substituants différents (sinon, il aurait un plan de symétrie) n’est pas superposable à son image dans un miroir comme le montre la figure suivante où le carbone central comporte quatre substituants différents notés A, B, D, E.
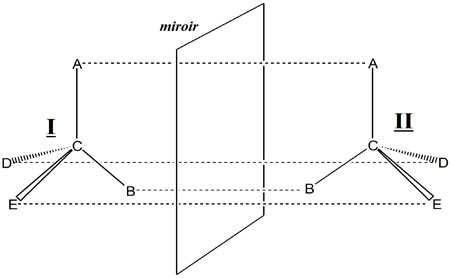
I et son image dans le miroir, II, ne sont pas superposables. La disposition spatiale des substituants de l’atome central s’appelle « configuration absolue ». Pour la définir sans ambiguïté, il faut une convention nécessitant un observateur lui-même chiral, c’est-à-dire possédant une main droite qui ne soit pas superposable à sa main gauche (8). Les deux molécules I et II, de configurations spatiales opposées sont appelés énantiomères. Leur mélange en quantité égale constitue un mélange dit racémique, ainsi que Pasteur l’avait précédemment énoncé.
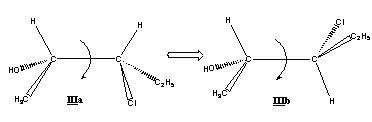
Il convient de distinguer la configuration, qui possède un caractère absolu (on ne peut la changer sans détruire la molécule), de la simple conformation, qui résulte d’une libre rotation autour d’un axe C-C ; ces conformations ne changent pas la nature de la molécule (ex. ci-dessous).
Janvier 2012

(1) De nombreux développements se trouvent dans : Symétrie m’était contée, C. Dézarnaud Dandine, A. Sevin, illustré par Piem, Ellipses, 2007.
(2) Platon, Timée, 46 a-b, traduction d’Albert Rivaud, Les Belles Lettres, p. 163, 1985.
(3) Pierre Duhem Sauver les phénomènes. Essai sur la notion de théorie physique de Platon à Galilée. Sozein ta phainomena, Bibliothèque des Textes Philosophiques, Paris, Vrin, 2005.
(4) Aristote, Traité du ciel, traduction J. Tricot, Vrin, 1998, p.72. Voir aussi : Traité des animaux, Livre I.
(5) E. Kant, Prolégomènes à toute métaphysique future, Pléiade, Œuvres complètes, tome 2, §13, p. 55.
(6) Voir l’analyse BibNum d’un texte de Fresnel (1822) : Jeanne Crassous, « La double réfraction de Fresnel et les molécules pharmaceutiques chirales », janvier 2009.
(7) « Recherches sur les propriétés spécifiques des deux acides qui composent l’acide racémique », in Annales de chimie et physique,3° série, XXVIII, p.56-99 ; repris dans Œuvres de Pasteur, tome premier, Dissymétrie moléculaire, Masson (1922), en ligne Gallica (la figure est p.90).
(8) Cette définition est tautologique ! Nous n’y pouvons rien.
(9) Aujourd’hui nous utilisons le terme « asymétrie ».
(10) Pasteur, La dissymétrie moléculaire, Conférence faite à la Société chimique de Paris le 22 décembre 1883. Extrait de Écrits scientifiques et médicaux, GF-Flammarion, 1994, p. 30-31 (aussi reprise dans Œuvres de Pasteur, Tome I, op. cit.)
(11) Prenons deux constituants A, B. Nous pouvons avoir : A(L)-B(L) ; A(L)-B(D) ; A(D)-B(L) ; A(D)-B(D) soit 22 composés distincts, nommés diastéréoisomères.

Christine Dézarnaud Dandine, Alain Sevin, ill. Piem, Symétrie m'était contée...: Histoires de symétries, Ellipses (2007)

Christine Dézarnaud Dandine, Alain Sevin, ill. Piem , Les formes élémentaires de la nature, Vuibert (2011).

Martin Gardner, L’univers ambidextre, les symétries de la nature, Point sciences, Seuil (1979).

Hermann Weyl, Symétrie et mathématique moderne, Flammarion (1952, souvent réédité).

F. Mathey et A. Sevin, Chimie moléculaire des éléments de transition, un dialogue entre théorie et expérience, Les éditions de l’École Polytechnique, Ellipses (2001).

Jean Sivardière, La symétrie en mathématique, physique et chimie, Presses Universitaires de Grenoble (1995).
Texte-pasteur.pdf

Analyse-pasteur.pdf

91-analyse-pasteur-sevinv2.pdf





