Introduction, en forme d’exposé des motifs
L’enseignement expérimental de la chimie revêt traditionnellement trois formes : l’apprentissage en laboratoire (travaux pratiques), les démonstrations de cours, et l’analyse d’expériences historiques ou de protocoles expérimentaux décrits et commentés par leurs auteurs.
Dans le premier mode, ce sont les élèves qui expérimentent, individuellement ou en groupe, sous la conduite d’un guide. Les expériences de cours sont réalisées, elles, par le professeur ou par un préparateur, et donnent des arguments expérimentaux pour poser quelque loi ou illustrer une propriété. Elles enseignent, certes, des gestes propres à la chimie, mais elles ne sont pas faites en priorité pour être reproduites par leur public. Elles doivent être aussi spectaculaires que possible pour intéresser les élèves et se graver dans leur mémoire. L’esthétique du dispositif, l’élégance des gestes de l’opérateur, la simultanéité, la précision, l’organisation du discours qui appelle l’attention des spectateurs sur les objets et transformations jugés importants et qui occulte ou dissipe les autres, enfin la représentation schématique proposée, sont autant de composantes de cet exercice didactique. L’expérience de chimie sollicite les sens, l’odorat, l’ouïe, parfois le toucher, toujours la vue, par un changement de couleur, l’apparition d’un précipité, l’émission d’un gaz, la lecture d’une mesure. Les principes de fonctionnement des appareils et matériels mis en œuvre doivent être transparents. L’expérience est présentée à un groupe nombreux, les spectateurs sont d’abord des témoins, chacun pour les autres, et ensemble, de la scientificité de la chimie, de son intelligibilité et de sa rationalité. Ce témoignage fonde leur adhésion à l’ensemble de concepts, de lois et de méthodes qui constituent la science chimique du moment. Le système de connaissances ainsi construit n’est pas clos : il est mobile, révisé ou généralisé à chaque nouvelle expérience, les témoins sont entraînés à croire que ce système ne peut être modifié et complété que par des démonstrations expérimentales – il n’a de fondement que par son caractère opératoire, pour concevoir d’autres expériences et interpréter d’autres faits expérimentaux ou d’observation. L’expérience de cours n’a pas pour première fonction de transmettre des connaissances, mais de transférer aux témoins une méthode de construction du système de connaissances.
L’expérience de cours a néanmoins disparu des cours des collèges, lycées et universités. Parmi les causes de cette disparition on peut retenir l’indisponibilité de locaux spécialisés, la formation technologique insuffisante des professeurs, notamment pour concevoir et fabriquer (travail du verre) un montage qui ne se trouve pas tout construit dans le commerce. On peut ajouter la disparition des chefs de travaux et l’interdiction d’utiliser certains produits jugés dangereux ou insalubres. Il y a surtout l’écart croissant entre les dispositifs didactiques et les appareils de haute technologie des laboratoires de recherche et de contrôle ou des unités de fabrication dont les mécanismes demeurent mystérieux derrière leurs emballages et qui sont pilotés par informatique. Certains craignent même que la simplicité et l’ingéniosité des dispositifs didactiques nuisent à l’image de la chimie moderne. Il en résulte que les enseignés sont entraînés désormais à poser des actes de foi en la parole du professeur.
@@@@@@@
Parmi les expériences historiques reprises dans presque tous les manuels français jusque dans les années 1970, figure l’expérience dite de Lavoisier – dont une partie était présentée en expérience de cours. Nous nous proposons d’analyser et de critiquer différentes descriptions de cette expérience en explicitant les intentions de leurs auteurs, les évolutions de la chimie qu’elles révèlent (vocabulaire, théories, matériel de laboratoire, statut de la représentation graphique d’une expérience…). Comme dans le jeu qui consiste à répéter une histoire dans l’oreille de son voisin pour voir ce qu’elle est devenue après un certain nombre de transmissions, le récit, nous le verrons, s’éloigne de plus en plus du texte de Lavoisier.
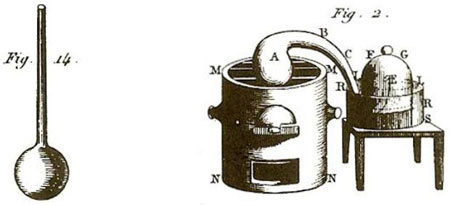
Figure 1 : Illustrations de Lavoisier (ici tirées de l’édition de 1862, Wikisource)
L’expérience décrite par Lavoisier
Sa première relation à des fins didactiques, accompagnée de deux figures, se trouve dans le Traité élémentaire de chimie (1789, tome I, p. 35 à 41 ; planches, tome 2). Elle commence par le dispositif, décrit avec une relative précision par l’auteur, qui s’exprime à la première personne :
J’ai pris, planche II, figure 14, un matras A de 36 pouces cubiques environ de capacité, dont le col BCDE était très long, & avait six à sept lignes de grosseur intérieurement. Je l’ai courbé, comme on le voit représenté, planche IV, figure 2, de manière qu’il pût être placé dans un fourneau MMNN, tandis que l’extrémité E de son col irait s’engager sous la cloche FG, placée dans un bain de mercure RRSS.
Lavoisier ne dit pas comment il engage ce tube recourbé sous la cloche. Vient ensuite la description du mode opératoire :
J’ai introduit dans ce matras quatre onces de mercure très pur, puis en suçant avec un siphon que j’ai introduit sous la cloche FG, j’ai élevé le mercure jusqu’en LL : j’ai marqué soigneusement cette hauteur avec une bande de papier collé, & j’ai observé exactement le baromètre & le thermomètre. Les choses ainsi préparées, j’ai allumé du feu dans le fourneau MMNN, & je l’ai entretenu presque continuellement pendant douze jours, de manière que le mercure fut échauffé presqu’au degré nécessaire pour le faire bouillir.
On recueillait et conservait les gaz insolubles dans l’eau sous une cloche renversée sur une cuve remplie d’eau, les gaz solubles dans l’eau étaient recueillis de la même façon sur une cuve remplie de mercure (bain de mercure) : c’est ce dernier cas que décrit Lavoisier. Le prix et la toxicité du mercure l’ont fait éliminer des laboratoires d’enseignement. Il est devenu difficile pour les étudiants d’aujourd’hui de comprendre le dispositif de Lavoisier qui utilise le mercure comme réactif dans le matras (à gauche) ET dans la cuve ou bain de mercure (à droite).
Lavoisier rapporte ensuite ses observations :
Il ne s’est rien passé de remarquable pendant tout le premier jour : le mercure quoique non bouillant, était dans un état d’évaporation continuelle […] Le second jour, j’ai commencé à voir nager sur la surface du mercure de petites parcelles rouges, qui, pendant quatre ou cinq jours ont augmenté en nombre & en volume ; après quoi elles ont cessé de grossir & sont restées absolument dans le même état. Au bout de douze jours voyant que la calcination du mercure ne faisait plus aucun progrès, j’ai éteint le feu & j’ai laissé refroidir les vaisseaux.
Les résultats quantitatifs sont notés :
Le volume de l’air contenu tant dans le matras que dans son col & sous la partie vide de la cloche, réduit à une pression de 28 pouces & à 10 degrés du thermomètre, était avant l’opération de 50 pouces cubiques environ. Lorsque l’opération a été finie, ce même volume à pression & à température égales, ne s’est plus trouvé que de 42 à 43 pouces : il y avait eu par conséquent une diminution de volume d’un sixième environ. D’un autre côté ayant rassemblé soigneusement les parcelles rouges qui s’étaient formées, & les ayant séparées autant qu’il était possible du mercure coulant dont elles étaient baignées, leur poids s’est trouvé de 45 grains.
L’expérience scientifique se doit d’être répétable et, en vérité, ce récit est une construction de l’esprit :
J’ai été obligé de répéter plusieurs fois cette calcination du mercure en vaisseaux clos, parce qu’il est difficile, dans une seule & même expérience, de conserver l’air dans lequel on a opéré, & les molécules rouges ou chaux de mercure qui s’est formé. Il m’arrivera souvent de confondre ainsi, dans un même récit, le résultat de deux ou trois expériences de même genre.
On appelait chaux métalliques ce que nous appelons oxydes. Ce nom n’est resté qu’à l’oxyde de calcium (chaux vive) et à son hydroxyde (chaux éteinte). Les produits sont caractérisés, par d’autres expériences :
L’air qui restait après cette opération & qui avait été réduit au cinq sixièmes de son volume, par la calcination du mercure, n’était plus propre à la respiration ni à la combustion ; car les animaux qu’on y introduisait y périssaient en peu d’instants, & les lumières s’y éteignaient sur le champ, comme si on les eût plongées dans de l’eau.

Figure 2 : L’oxyde de mercure HgO, de couleur orange à rouge caractéristique (image Wikimédia Commons)
Compte tenu de sa durée, cette expérience ne pouvait être reproduite intégralement en classe, les professeurs se contentant de refaire en cours la partie qui suit :
D’un autre côté, j’ai pris les 45 grains de matière rouge qui s’était formée pendant l’opération ; je les ai introduits dans une très petite cornue de verre à laquelle était adapté un appareil propre à recevoir les produits liquides & aériformes qui pourraient se séparer : ayant allumé du feu dans le fourneau, j’ai observé qu’à mesure que la matière rouge était échauffée sa couleur augmentait d’intensité. Lorsqu’ensuite la cornue a approché de l’incandescence, la matière rouge a commencé à perdre peu à peu de son volume, & en quelques minutes elle a entièrement disparu ; en même temps il s’est condensé dans le petit récipient 41 grains ½ de mercure coulant, & il a passé sous la cloche 7 à 8 pouces cubiques d’un fluide élastique beaucoup plus propre que l’air de l’atmosphère à entretenir la combustion & la respiration des animaux. Ayant fait passer une portion de cet air dans un tube de verre d’un pouce de diamètre & y ayant plongé une bougie, elle y répandait un éclat éblouissant ; le carbone au lieu de s’y consommer paisiblement comme dans l’air ordinaire, y brûlait avec flamme & une sorte de crépitation, à la manière du phosphore, & avec une vivacité de lumière que les yeux avoient peine à supporter.
Construction collective de l’esprit humain, la science chimique a une histoire que Lavoisier ne peut totalement évacuer ; elle est en outre véhiculée par une langue, c’est un aspect qu’il aime :
Cet air que nous avons découvert presque en même temps, M. Priestley, M. Schéele & moi, a été nommé par le premier, air déphlogistiqué ; par le second, air empiréal. Je lui avais d’abord donné le nom d’air éminemment respirable : depuis, on lui a substitué celui d’air vital. Nous verrons bientôt ce qu’on doit penser de ces dénominations.
En réalité, les recherches rapportées par Lavoisier, dans cet ouvrage qu’il destine à l’enseignement, ont été faites dans un contexte très concurrentiel et polémique qu’il s’emploie à gommer à son profit. En s’exprimant à la première personne, il s’attribue le dispositif et le choix de l’oxyde de mercure (II) qui reviennent pourtant à Priestley
(1). Aujourd’hui peu de chercheurs ont le goût de transcrire les recherches de leur temps dans des ouvrages d’enseignement construits, lesquels ne sont ni remplaçables ni remplacés par les actes de colloque. Ce serait, pour certains chercheurs, du temps soustrait à la recherche scientifique, un exercice réducteur auquel un vrai « savant » ne saurait s’adonner sans déchoir du rang de créateur à celui de compilateur. Le poids de l’ouvrage de Lavoisier, grâce auquel il réussit à imposer sa théorie antiphlogistique, fut tel qu’il offre un démenti historique formel à ces chercheurs contemporains.
Lavoisier interprète ensuite les observations et les identifications :
En réfléchissant sur les circonstances de cette expérience, on voit que le mercure en se calcinant absorbe la partie salubre & respirable de l’air, ou, pour parler d’une manière plus rigoureuse, la base de cette partie respirable ; que la portion de l’air qui reste est une espèce de mofète
(2), incapable d’entretenir la combustion & la respiration : l’air de l’atmosphère est donc composé de deux fluides élastiques de nature différente & pour ainsi dire opposée.
Au début du chapitre, Lavoisier avait rappelé la complémentarité de l’analyse et de la synthèse :
En général on ne doit être pleinement satisfait en Chimie qu’autant qu’on a pu réunir ces deux genres de preuves.
À Berthelot qui, pour valoriser sa contribution, prétendait que la synthèse était une activité supérieure à l’analyse, Chevreul rappellera plus tard cette opinion équilibrée du « fondateur » que Lavoisier met ici en application :
Une preuve de cette importante vérité, c’est qu’en recombinant les deux fluides élastiques qu’on a ainsi obtenus séparément, c’est-à-dire, les 42 pouces cubiques de mofète, ou air non respirable, & les 8 pouces cubiques d’air respirable, on reforme de l’air, en tout semblable à celui de l’atmosphère, & qui est propre à peu près au même degré, à la combustion, à la calcination des métaux, & à la respiration des animaux.
Aujourd’hui on ne parlerait plus de "synthèse de l’air", mais de reconstitution du mélange, réservant le terme synthèse aux opérations par lesquelles, à partir de réactifs, on réalise de nouvelles combinaisons.
Le mercure chauffé a fixé un constituant de l’air
La mofète, on l’a compris, correspond à l’azote (3) (« air non respirable »), tandis que l’autre partie (« l’air respirable », qui donne un éclat aveuglant à la bougie) correspond à l’oxygène. Quand Lavoisier fait référence aux proportions ci-dessus (42 volumes de mofète pour 8 d’air éminemment respirable), ceci correspond approximativement aux proportions volumiques de l’air (78 % d’azote et 22 % d’oxygène, chez Lavoisier 84 et 16). La première réaction de Lavoisier [obtention de « chaux de mercure » rouge, c'est-à-dire d’oxyde de mercure (II)] correspond à l’équation 2 Hg + O2 → 2 HgO : l’oxygène de l’air emprisonné dans le matras, son col et la cloche, est utilisé dans cette oxydation – reste l’azote, qui n’entretient pas la vie animale.

Figure 3 : Flocules d’oxyde de mercure, à nouveau (WikiCommons auteur Materialscientist)
La seconde réaction est la réaction inverse, c’est-à-dire la réduction de l’oxyde de mercure (II) : l’oxygène dégagé passe de la petite cornue de verre sous la cloche, puis une partie de cet oxygène prélevée dans un tube de verre ravive la flamme d’une bougie qu’on plonge dans ce tube. Parmi les corps chimiques, le mercure est le seul métal à l’état liquide à température ordinaire, et avec une température d’ébullition très basse, à 350 °C : son oxydation est rapide (la réaction d’oxydation du fer solide en rouille est beaucoup plus lente !). À cette température, c’est l’oxyde de mercure (II) qui se forme, HgO (précédemment appelé oxyde mercurique).
Cette expérience avait un intérêt pour préparer l’oxyde rouge de mercure : c’est celui que lui avait assigné Priestley, et que Lavoisier, dans le contexte polémique de l’époque, réduit à presque rien, en une phrase :
Quoique cette expérience fournisse un moyen infiniment simple d’obtenir séparément les deux principaux fluides élastiques qui entrent dans la composition de notre atmosphère, elle ne nous donne pas des idées exactes sur la proportion de ces deux fluides. L’affinité du mercure pour la partie respirable de l’air, ou plutôt pour sa base, n’est pas assez grande pour qu’elle puisse vaincre entièrement les obstacles qui s’opposent à cette combinaison.
On croyait alors que la chaleur (le calorique) « en se combinant avec les corps, en volatilise quelques-uns et les réduit à l’état aériforme : la permanence de cet état à la température de l’atmosphère constitue les gaz
(4) ». Selon cette théorie, Lavoisier avance une explication :
Ces obstacles sont l’adhérence des deux fluides constitutifs de l’air de l’atmosphère & la force d’affinité qui unit la base de l’air vital au calorique : en conséquence la calcination du mercure finie, ou au moins portée aussi loin qu’elle peut l’être, dans une quantité d’air déterminée, il reste encore un peu d’air respirable combiné avec la mofète, & le mercure ne peut en séparer cette dernière portion. Je ferai voir dans la suite que la proportion d’air respirable & d’air non respirable qui entre dans la composition de l’air atmosphérique est dans le rapport de 27 à 73, au moins dans les climats que nous habitons : je discuterai en même temps les causes d’incertitude qui existent encore sur l’exactitude de cette proportion.

Figure 4 : Joseph Priestley (1733-1804), théologien, philosophe et scientifique anglais.
À l’époque de Lavoisier, on ne distinguait pas le mélange de la combinaison, confondus dans le concept de mixte – c’est Proust, sorti vainqueur d’une mémorable discussion poursuivie pendant plusieurs années (1803-1806) contre Berthollet, qui a imposé la loi des proportions définies : chaque combinaison chimique a une composition fixe, spécifique, rigoureusement indépendante des conditions dans lesquelles elle a pris naissance, au contraire des mélanges où les proportions des corps constituants sont variables. L’air n’est pas une combinaison, c’est un mélange, néanmoins sans être rigoureusement constantes, les proportions de dioxygène et de diazote dans divers échantillons d’air atmosphérique varient peu. L’eau est une combinaison d’oxygène et d’hydrogène dans laquelle le rapport des éléments est constant.
On ne distinguait pas non plus le corps pur simple de l’élément, tels le gaz O2 que nous nommons dioxygène depuis une vingtaine d’années (parce que sa molécule est diatomique) et l’élément oxygène O qui se trouve dans l’eau, dans le dioxygène, dans l’éthanol, etc.
Dans ce qui suit, Lavoisier cherche à démontrer qu’il n’a pas fait cette expérience par hasard : mais il occulte soigneusement le rôle du contexte international, la mémoire des expériences que lui avait décrites Priestley en visite à Paris, ainsi que ses propres errements dans l’interprétation des résultats (Observations sur la physique, mai 1775). La démarche qu’il présente est reconstruite, dans le but d’imposer l’idée qu’il aurait conçu l’expérience pour vérifier une hypothèse préalable, et pour donner du chimiste – lui-même – l’image fabriquée d’un professionnel guidé par sa seule raison. Il veut convaincre que sa théorie de la combustion a des fondements rationnels. Ce n’est pas un compte rendu d’expérience, c’est une plaidoirie, et l’ouvrage a des objectifs médiatiques autant que didactiques. Nombreux sont les exemples d’une reconstruction analogue dans les comptes rendus de recherches contemporaines. Il est probable cependant qu’une présentation plus fidèle aux chemins historiques par lesquels les chercheurs progressent serait plus fructueuse pour enseigner à innover.
@@@@@@@
En unités actuelles un pouce cubique vaut 19,8 cm3, une ligne à peu près 0,2 cm, un pouce 2,7 cm, un grain 5,33 cg, une once 30,6 g. Des mesures de masse qu’il avait soigneusement consignées, Lavoisier eût pu calculer les proportions de mercure et d’oxygène dans l’oxyde, et constaté leurs permanences. La loi des proportions définies ou loi de Proust et la théorie atomique n’agitaient pas encore le monde savant. Cette interprétation que nous pouvons faire aujourd’hui de ses résultats ne retient donc pas l’intérêt de Lavoisier.
La première partie de l’expérience, non plus, n’était pas neuve ; en 1751 déjà, P. J. Macquer (1718-1784) décrivait la préparation de l’oxyde rouge de mercure, auquel on reconnaissait des propriétés médicamenteuses dans le traitement d’affections ophtalmologiques : on chauffe du mercure dans de « petits matras de verre, dont les cols soient longs & étroits », dans lesquels le mercure vaporisé se condense, bouchés sommairement « avec un peu de papier, afin d’empêcher qu’il n’y tombe quelque ordure [ …]. Cette opération dure trois mois
(5) ». Macquer ignore le rôle du dioxygène. L’oxyde était appelé « mercure précipité per se », un « nom qui lui convient, dit-il, en ce qu’il est effectivement réduit sous la forme d’un précipité,
& cela sans qu’il ait été mêlé à aucune autre substance : mais qui d’un autre côté est fort impropre, attendu que dans la réalité ce mercure n’est point un précipité, n’ayant point été séparé d’avec aucun menstrue qui le tenoit en dissolution ». Le terme « réduit » n’a pas ici son sens chimique ; un
menstrue désignait un solvant, un
précipité est une substance solide qui se sépare d’une solution liquide.
En 1794, Chaptal, pourtant acquis aux idées de Lavoisier, écrit, mais sans le citer, que l’oxyde se forme « si on aide l’
action de l’air par le moyen de la chaleur […] au bout de quelques mois
(6) ». Il renvoie (t. 1, p. 114) à la description du
gazomètre puisée dans le
Traité élémentaire de chimie de Lavoisier, mais il atteste l’antériorité des travaux de Priestley et moins nettement celle de Scheele. En effet, parlant du « gaz oxigène ou air vital » (t. 1, p. 105), Chaptal écrit : « Cette substance gazeuse a été découverte par le célèbre
Priestley le premier août 1774 », et « Le gaz oxigène est le seul propre à la combustion : cette vérité reconnue lui a fait donner le nom d’
air du feu par le célèbre
Scheele », assurant (p. 114) que « Lavoisier et Ehrmann ont soumis presque tous les corps connus à l’action du feu alimenté par le seul gaz oxigène, et ont obtenu des effets que le miroir ardent (utilisé par Priestley) n’avait pas pu opérer ».
La reconnaissance de la « révolution » théorique opérée par Lavoisier et du rôle fondateur qu’il attribue à son expérience d’analyse de l’air n’est venue qu’après sa tragique disparition.
Les présentations successives de cette expérience et leur évolution
Après la mort de Lavoisier, le Traité élémentaire de Chimie devient en quelque sorte un testament dont les conclusions sont pieusement reprises par tous les chimistes français.
Nous avons examiné une cinquantaine d’ouvrages d’enseignement en langue française, depuis Lavoisier jusqu’à nos jours. Nous en choisissons quelques-uns pour les évolutions qu’ils révèlent. La relation de l’expérience dite de Lavoisier ne quittera plus les manuels de chimie pendant presque deux siècles : elle est rappelée dans le chapitre sur l’oxygène, ou (et) dans celui sur l’air atmosphérique.
@@@@@@@
Dans la traduction (de l’anglais) des Elémens de chimie expérimentale de William Henry (6e édition), par Gaultier-Claubry, en 1812 (p. 161-164), on relève quelques différences significatives par rapport à la relation faite par Lavoisier en 1789.
Après avoir séparé d’une quantité d’air atmosphérique tout l’oxigène qu’il contient, il reste un gaz que Lavoisier a nommé Gaz Azote, nom dérivé de son impuissance à soutenir la vie des animaux
(7) […]. Ceci n’étant cependant qu’une propriété négative, on a pensé que c’était un nom impropre pour la nomenclature, et on lui a substitué le mot Nitrogène, parce qu’une des plus intéressantes propriétés de sa base est de former l’acide nitrique par son union avec l’oxigène.
En accord avec la gravure de Lavoisier lui-même, l’auteur ne parle pas d’un matras mais d’une cornue. Le fait que le système soit clos est exprimé par « une quantité donnée » d’air. Les précisions quantitatives de Lavoisier ont disparu, mais d’autres observations apparaissent :
Le mercure souffrit aussi un changement considérable, une partie n’était plus sous la forme d’un métal brillant et fluide, mais changée en parties rouges feuilletées, et son poids était augmenté.
Notons que cette augmentation de masse due à la fixation d’oxygène (environ 18 cg) dans 45 grains d’oxyde (2,4 g), que Lavoisier ne signale pas, ne doit pas être aisée à mesurer.
Dans l’ouvrage de W. Henry, la synthèse de l’air reconstitué par Lavoisier n’est pas rapportée. Enfin il n’y a aucun schéma du dispositif de Lavoisier, ce qui indique que son expérience, longtemps décrite dans l’enseignement français, n’a pas eu la même importance dans d’autres pays (voir Stöckhardt, 1861). Son rappel par Henry n’est qu’historique et, en 1812, l’interprétation donnée par Lavoisier n’est plus contestée par personne.
@@@@@@@
En 1827, dans le Cours de chimie de Colin (p. 92), à l’usage des élèves de Saint-Cyr, quelques précautions opératoires font penser que l’auteur a vu refaire ou refait lui-même tout ou partie de l’expérience. Un schéma accompagne le texte.
Dans une cornue dont le col très long était recourbé à peu près en col de cygne renversé, Lavoisier mit du mercure (fig. 53) : on savait depuis longtemps que ce métal tenu en ébullition dans un vase appelé enfer de Boyle, se convertissait en une poudre rouge ; en conséquence, il plaça la cornue sur un fourneau ; après avoir fermé d’un papier l’issue de ce vase, il l’engagea sous le mercure d’une cuve, et sous une cloche à peu près remplie de mercure qu’il avait disposée à cet effet. Le bec de la cornue se relevait assez pour atteindre à la partie supérieure qui contenait de l’air ; en sorte que sans craindre d’introduire dans la cornue de nouveau mercure, il put au moyen d’un fil de fer courbe, retirer le papier qui en défendait l’entrée. Cela fait, il prit note du volume total de l’air, tant dans la cornue que sous la cloche, de la hauteur du mercure, qui dans celle-ci se trouvait au-dessus du niveau, et enfin de la température et de la pression atmosphérique ; puis il mit du feu sous la cornue. Vers le cinquième jour des paillettes rouges se manifestèrent, et continuèrent ainsi à augmenter jusqu’au douzième ou quinzième jour. A cette époque, les paillettes n’augmentant plus, l’opération fut arrêtée. Le volume d’air avait diminué, par conséquent le mercure était remonté dans la cloche ; Lavoisier s’assura qu’on ne pouvait attribuer ce changement ni à la température ni à la pression de l’air extérieur. Il défit l’appareil, examina le résidu gazeux, et le trouva impropre à la combustion et à la respiration ; il le nomma azote, du mot grec , vie, et de l’a privatif des Grecs. Puis ayant retiré de la cornue et séparé du mercure la matière rouge qui s’y était formée, il distilla ces paillettes rouges, et obtint d’une part du mercure coulant, et de l’autre un gaz qui avait toutes les propriétés du gaz oxigène, et qui, n’en ayant point d’autres, ne s’en distinguait pas. D’où il conclut avec raison que l’air était un mélange d’oxigène et d’azote. Il voulut aussi en déduire leurs quantités respectives, mais les résultats qu’il obtint alors manquent d’exactitude, par la raison que dans cette expérience il fut obligé d’avoir égard à un trop grand nombre de données, et que chacune de celles-ci pouvant être la cause d’une petite erreur, l’erreur totale fut en définitive assez forte. C’est donc parce que ce moyen de déterminer le dosage des éléments de l’air, n’est pas à beaucoup près aussi simple que l’analyse par l’eudiomètre, que par cela même celle-ci est plus rigoureuse.
C’est une narration plutôt qu’une démonstration. L’auteur donne des explications sur le mode opératoire que Lavoisier avait jugé inutile de développer. Curieusement la déduction précède l’observation : « Le volume d’air avait diminué, par conséquent le mercure était remonté dans la cloche. » Cette « perversion » de l’enseignement expérimental est pratique courante : du statut de démonstration, l’expérience de cours est passée à celui d’une illustration, voire d’une distraction-récréation. Colin se dispense de divaguer sur le calorique ; la raison qu’il donne de l’erreur commise sur les proportions de dioxygène et de diazote dans l’air est celle d’un analyste, pas celle d’un théoricien.
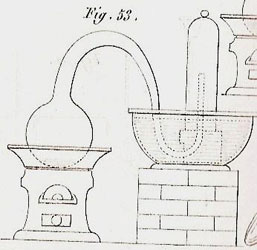
Figure 5 : Illustration de Colin, 1827.
Le schéma est nouveau, rassemblé avec d’autres sur une planche située à la fin de l’ouvrage ; il présente un ballon à fond rond sur un fourneau à collerette, le tube abducteur en S part du sommet du ballon, il s’élève à peu près verticalement d’une hauteur sensiblement égale à celle du ballon, son diamètre va en diminuant, il passe sous un têt et s’élève à mi-hauteur dans une cloche étroite. Le mercure affleure au bord de la cuve, en forme de saladier aux flancs arrondis, élevée sur un socle de brique à hauteur du ballon, le niveau du mercure est le même dans la cloche et dans la cuve. Le schéma sera copié. On trouve sensiblement le même sur une planche de Berthier
(8).
En 1844, après avoir longuement rappelé les observations de Jean Rey et Bayen, dans son Traité élémentaire de chimie industrielle, Dupasquier cite intégralement (p. 131 à 134), dans une note, les pages 27 à 31 du Traité de Lavoisier. Tout l’ouvrage donne une importance exceptionnellement grande aux aspects historiques. À propos de l’azote,
Lavoisier avait songé aux mots alkaligène et nitrigène ; mais il n’adopta ni l’un ni l’autre, parce qu’ils entraînaient, dit-il, une idée systématique [p. 110].
@@@@@@@
Dans la Chimie élémentaire de Bouchardat (2nde édition, 1845, p. 24), le contexte de concurrence dans lequel opérait Lavoisier a définitivement disparu. Bouchardat écrit les nombres qui mesurent les volumes et les masses en toutes lettres, ce qui réduit leur visibilité et leur importance. Exposant ensuite l’expérience d’analyse de l’air par le phosphore sous une cloche graduée, l’auteur écrit les nombres en chiffres arabes : « l’air serait donc composé de 21 volumes de gaz oxygène et de 79 de gaz azote », de sorte, peut-on penser, que ce soient ceux-là qui se gravent dans la mémoire des lecteurs.
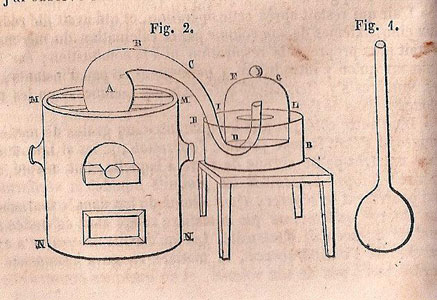
Figure 6 : Illustration de Bouchardat, 1845.
ouchardat accompagne le texte de deux schémas qui reproduisent avec fidélité les gravures de Lavoisier. À côté du matras, figure une sorte de cornue dont le col assez large ne peut pas provenir du matras par une simple courbure de son long col ; elle est posée sur un énorme fourneau, le rapport entre la taille du fourneau et celle de la cornue (36 pouces cubiques représentent environ 700 cm3) est d’abord surprenant, il ne l’est plus si l’on se rappelle que 4 onces de mercure occupent moins de 9 cm3, c’est peut-être ce petit volume dont s’est souvenu le dessinateur ou sur lequel il a tenu à insister ; la cloche est basse mais large, de sorte qu’on peut douter que les variations de volume du gaz soient aisément mesurables ; elle est suspendue dans la cuve à mercure en forme de cristallisoir, plein à ras bord sur une table basse à quatre pieds et qui s’élève à mi-hauteur du fourneau.
@@@@@@@
Dans son Cours élémentaire de chimie (3e édition, 1851, p. 131), Regnault cite, en note, Lavoisier. On sait que Regnault se rattachait à l’école positiviste, et par suite il avait choisi de faire un exposé dogmatique de la science : il éliminait volontairement les références à tout déploiement historique de la chimie – il fait donc ici une remarquable exception.
La citation commence avec la description du dispositif. Elle est accompagnée, non d’un schéma mais d’une gravure, représentant un matras au col fin recourbé, posé sur le triangle (ou chevrette) d’un fourneau actualisé. La cloche a les proportions d’une grosse éprouvette à gaz, son volume est important relativement au matras. Dans le texte les mots calcination et se calcinant sont suivis d’explications entre parenthèses : oxydation du mercure et s’oxydant. Calcination signifie combustion, ces explications sont donc déjà des interprétations. Regnault élimine le bref rappel des travaux de Priestley et de Scheele. « La partie salubre et respirable de l’air » n’est plus suivie de la correction que Lavoisier avait cru devoir apporter (« ou, pour parler d’une manière plus rigoureuse, la base de cette partie respirable ») : Regnault prend acte de l’évolution des théories sur la chaleur, à laquelle il a contribué. Les explications relatives à l’erreur commise sur les proportions sont abrégées :
Lavoisier ajoute que la proportion du gaz respirable, trouvée par son expérience, est probablement un peu trop faible, parce qu’on ne parvient pas à la combiner entièrement au mercure.

Figure 7 : Illustration de Regnault, 1851.
En 1854, Pelouze et Fremy, dans leur Traité de chimie générale (2e édition, t. 1er, p. 240), réduisent la description du dispositif pour ne retenir que l’essentiel des conclusions. Ce récit conserve alors une fonction démonstrative mais n’enseigne pas à concevoir des expériences et à interpréter leurs résultats. En même temps, les auteurs abandonnent les données numériques avec les unités en usage au temps de Lavoisier et devenues obsolètes.
Lavoisier s’assura que le gaz qui restait dans la cloche avait des propriétés entièrement opposées à celles de l’air atmosphérique ; qu’il était impropre à la combustion et à la respiration : ce gaz était l’azote. Il introduisit ensuite dans une petite cornue le peroxyde de mercure qui s’était formé à la surface du mercure, le chauffa jusqu’au rouge naissant, et vit qu’il se décomposait en mercure métallique et en un gaz qui était, comme il l’a dit, beaucoup plus propre que l’air atmosphérique à entretenir la combustion et la respiration des animaux. Ce gaz était l’oxygène.
Cette présentation abandonne donc l’idée d’une découverte des deux gaz, comme si Lavoisier n’avait eu qu’à les reconnaître. Mais c’est bien le cas de ceux qui reproduisent l’expérience au moment où le livre paraît. Ce sera désormais le choix adopté dans les manuels.
Bons pédagogues, les auteurs résument en une phrase ce qui précède, comme on fait suivre un exposé d’un bref résumé des conclusions à faire retenir.
Lavoisier avait donc retiré de l’air atmosphérique deux gaz différents : l’un entretenant la combustion et la respiration, l’oxygène ; l’autre impropre à la combustion et à la respiration, l’azote.
Passant sous silence les travaux de Priestley, les auteurs reconnaissent que la synthèse de l’air est un argument fort du raisonnement de Lavoisier :
Les travaux de Scheele ont moins attiré l’attention que ceux de Lavoisier, parce qu’ils ne présentent pas la même évidence ; ce qui tient à ce que les sulfures alcalins ne peuvent pas, comme l’oxyde de mercure, restituer facilement l’oxygène qu’ils ont absorbé
En réalité, si les travaux de Scheele ont eu moins de retentissement, c’est surtout parce qu’il n’en a pas tiré de conclusion théorique sur le rôle de l’oxygène dans la transformation des métaux en « chaux » (oxydes). Pelouze et Frémy ne manquent pas de généraliser :
Nous examinerons successivement les procédés employés aujourd’hui pour doser les principaux constituants de l’air atmosphérique […]. La première méthode consiste à introduire dans un volume connu d’air atmosphérique des corps pouvant absorber l’oxygène à froid ou à chaud, tels que le phosphore, l’hydrogène, les métaux, etc. La diminution de volume éprouvé par l’air atmosphérique indique la proportion d’oxygène qu’il contient ; le résidu gazeux donne l’azote. La seconde méthode consiste à faire passer de l’air sur un corps avide d’oxygène, qui le fixe et en donne la proportion par l’augmentation de poids qu’il éprouve ; l’azote est ensuite dosé, soit par une pesée, soit par une mesure de volume.
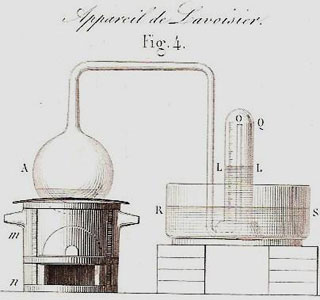
Figure 8 : Illustration de Pelouze & Frémy, 1854.
@@@@@@@
Dans la traduction (de l’allemand), par Brustlein, d’un ouvrage de Stöckhardt, intitulée La Chimie usuelle appliquée à l’agriculture et aux arts (11e édition, 1861, p. 79), on signale : « Composition de l’air. Déterminée par Lavoisier et Scheele en 1777, et plus exactement par Gay-Lussac et Humboldt en 1801 », mais on propose une autre expérience.
Une petite éponge fixée au bout d’un fil de fer et imbibée d’alcool est disposée sur l’eau (fig. 53), de telle sorte qu’elle se soutienne à quelque distance au-dessus du liquide ; après avoir allumé l’alcool, on renverse sur l’éponge un flacon vide de manière que le goulot plonge à une certaine profondeur sous l’eau. La flamme ne tarde pas à s’éteindre, le volume diminue, et il entre dans le flacon une quantité d’eau égale à celle de l’air que la combustion a fait disparaître. Le gaz disparu n’est autre que l’oxygène combiné avec l’alcool. […] Quant au gaz resté dans le flacon, un corps allumé s’y éteindrait, un animal y mourrait […].
Malgré des imprécisions, quantité pour volume, l’oxygène combiné avec l’alcool, il faut saluer la mise en garde suivante : « Ces deux corps (oxygène et azote) ne sont pas combinés dans l’air, ils s’y trouvent simplement mélangés. » C’est le premier manuel de notre corpus qui insiste sur cette importante distinction.
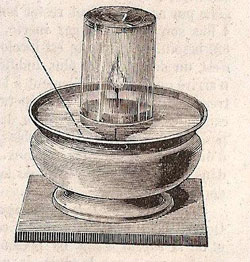
Figure 9 : Illustration de Stöckhardt, 1861. On y voit la flamme de la bougie sous oxygène.
@@@@@@@
En 1860, « l’expérience de Lavoisier » est rapportée dans les Notions de chimie de Boutet de Monvel (p. 30), ouvrage destiné à la classe de seconde, section des Lettres : « Il se servit d’un ballon à long col recourbé comme un tube à recueillir les gaz ; l’extrémité de ce tube plongeait sous un têt troué et montait à l’intérieur d’une éprouvette », définie deux pages auparavant comme une cloche en verre, cylindrique et étroite.
Peu à peu le mercure perdit sa fluidité et se transforma en une poudre rouge qu’on appelait alors le précipité rouge de mercure et qui n’est autre chose qu’un oxyde de ce métal
Cette description semblable à une « prise en masse » du liquide n’est évidemment pas celle d’un témoin direct. Ce que l’auteur nomme « tube à recueillir les gaz » est un « tube à dégagement », le gaz étant recueilli in fine dans une « éprouvette à gaz ».
Boutet de Monvel fait appel à un caractère analytique du dioxygène connu de lui, mais que Lavoisier n’emploie pas :
Quant au gaz renfermé dans l’éprouvette, non seulement il ne rallumait pas les corps en ignition, comme l’oxygène, mais il n’entretenait même pas la combustion, comme pouvait le faire l’air ; une allumette enflammée s’y éteignait immédiatement, et un animal qu’on introduisait dans la cloche y périssait aussitôt.
L’auteur termine par l’indication d’une antériorité que Lavoisier ne signalait pas : « Lavoisier reconnut dans ce gaz un corps découvert un an auparavant par un chimiste anglais, Rutherford, et lui donna le nom d’azote ». On reconnaît, en effet, à Daniel Rutherford (1749-1819), élève de Joseph Black (1728-1799) la description d’un nouveau gaz dans l’air, qui n’entretient pas les combustions, en 1772, à Édimbourg.
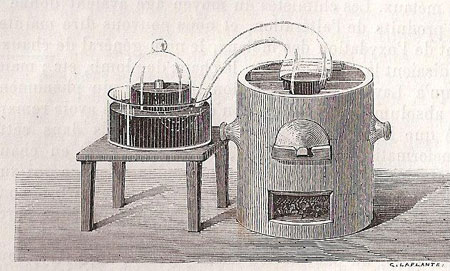
Figure 10 : Illustration de Boutet de Monvel, 1860.
@@@@@@@
Dans son Traité de chimie générale élémentaire (t. 1er, 2e édition, 1860, p. 118-121), Cahours n’attribue à Lavoisier ni le dispositif, ni l’idée de l’oxyde de mercure (II), seulement leur emploi à des fins analytiques : « Nous allons décrire sommairement le procédé qu’il mit en usage pour faire l’analyse qualitative de l’air. » Il donne d’abord le principe de ce procédé, tel qu’on le comprend à l’époque de Cahours :
La méthode employée par ce chimiste repose sur la propriété dont jouit le mercure de s’oxyder à une température déterminée, puis de reprendre l’état métallique en abandonnant le gaz oxygène auquel il s’était uni, lorsqu’on dépasse cette température. L’expérience fut exécutée par Lavoisier dans un appareil qui porte le nom d’enfer de Boyle. Celui-ci consiste (fig. 34) en un matras, dont le col très long était doublement recourbé de façon que la branche ouverte pût parvenir au sommet d’une cloche placée sur le mercure.
L’enfer de Boyle, déjà bien nommé par Colin, était l’appareil utilisé pour préparer l’oxyde rouge de mercure. Klaproth & Wolff, dans leur Dictionnaire de chimie, traduit de l’allemand par Bouillon-Lagrange et Vogel (t. 3e, p. 89, 1811), justifient son usage et sa forme :
On introduit du mercure dans un matras à fond plat et terminé par un tube capillaire. On le fait bouillir continuellement sur un bain de sable, à une température qui ne doit pas surpasser celle de 700 degrés Fahr. la hauteur de matras et son ouverture étroite, empêchant que le mercure ne s’échappe en même temps ; le contact de l’air n’est pas exclu.
On peut donc penser que c’est le choix de l’oxyde de mercure rouge, inspiré par Priestley, qui a déterminé l’utilisation par Lavoisier de ce matras, plutôt que d’une cornue. Il est probable qu’en 1860, on ne se souvenait plus du nom de ce matras à long col que parce qu’il avait servi, après transformation, dans l’expérience historique de Lavoisier. Cahours donne des indications quantitatives qu’il n’exploite pas par la suite, certaines inexactes : « Tout étant ainsi disposé, le mercure fut chauffé jusqu’à l’ébullition et maintenu à cette température pendant douze à quinze jours.» De la décomposition de l’oxyde, il écrit :
et l’on obtint une quantité de gaz oxygène, représentant parfaitement la différence entre le volume primitif de l’air et celui que présentait le gaz lorsqu’on mit fin à l’expérience […]. L’air avait cédé dans cette circonstance une quantité d’oxygène égale au cinquième environ de son volume. Le gaz restant, qui formait un peu plus des 4/5 du volume de l’air employé, présentait toutes les propriétés de l’azote.
Notons que Lavoisier estimait la diminution de volume de l’air à 1/6e. Cahours s’étend plus que ses prédécesseurs sur l’expérience de Scheele, mais il ajoute : « Sa méthode, quoique ingénieuse et simple, était donc de beaucoup inférieure à celle du chimiste français. » On remarquera qu’influencé par les idées nationalistes qui se développent en Europe à partir de 1848, l’auteur prend soin de signaler la nationalité des savants.
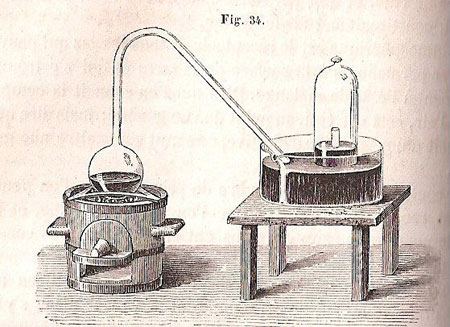
Figure 11 : Illustration de Cahours, 1860.
@@@@@@@
Avec Riche, Cahours est l’auteur d’une Chimie des demoiselles (1868) qui reprend le texte de leurs leçons créées à la Sorbonne pour l’enseignement secondaire des filles, « il faut, écrivent-ils, l’envisager comme une suite raisonnée d’entretiens sur les métalloïdes ainsi que sur les composés de ces corps qui jouent un rôle important dans l’économie de la nature ou qui ont reçu des applications utiles dans la vie domestique et dans les arts ». Jusque dans les années 1960, on appelait métalloïdes les éléments non métalliques. L’expérience de Lavoisier figure dans les deux premières leçons intitulées Air atmosphérique et Oxygène :
Bayen fit le premier cette expérience ; mais ce fut Priestley qui remarqua que le gaz dégagé différait entièrement de l’air ordinaire ; c’est donc véritablement à lui qu’on en doit la découverte. Pour recueillir le gaz on introduit une certaine quantité de cet oxyde de mercure dans une petite cornue de verre (fig. 6) que l’on chauffe soit au moyen de quelques charbons, soit à l’aide d’une lampe à gaz. On adapte au col de la cornue un tube doublement recourbé dont on engage l’extrémité sous une éprouvette remplie d’eau. Le gaz au fur et à mesure de sa production expulse ce liquide dont il prend la place et vient se rassembler dans l’éprouvette qui repose sur une capsule de terre, ou têt, percée d’une ouverture centrale, qui lui permet de se rendre dans la cloche, et d’une échancrure latérale dans laquelle s’engage le tube à dégagement. Bien que cette méthode soit d’une simplicité parfaite, on ne saurait cependant l’employer en raison du prix élevé de l’oxyde de mercure. On remplace ce produit avec avantage par un composé que la nature nous offre en quantités considérables, le peroxyde ou bioxyde de manganèse.
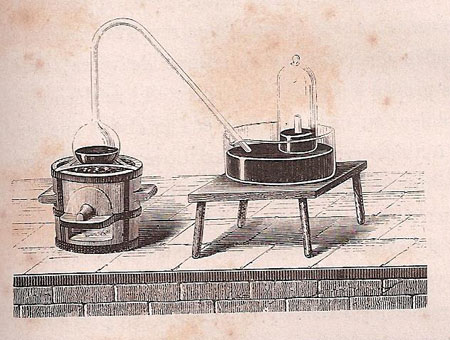
Figure 12 : Illustration de Cahours & Riche, 1868.
@@@@@@@
En 1863, paraissait la troisième édition des Leçons élémentaires de chimie de Malaguti. Les précurseurs de Lavoisier sont exceptionnellement et longuement évoqués par l’auteur qui conteste la thèse du hasard ; commentant la décomposition de l’oxyde rouge de mercure, il écrit :
En opérant ainsi, nous sommes arrivés au même résultat que Priestley ; la preuve, c’est que, si nous plongeons dans une éprouvette pleine du gaz que nous venons de préparer une bougie allumée, nous verrons sa flamme devenir éclatante (fig. 4).
Malaguti s’interroge sur l’origine du choix de l’oxyde rouge de mercure fait par Priestley :
Priestley avait donc opéré sur une combinaison de mercure et d’oxygène ; par une température élevée, les deux éléments s’étaient séparés pour reprendre, l’un son éclat métallique, l’autre la forme gazeuse. [Mais qui l’amena à expérimenter précisément sur cette substance ? Une discussion dans le sein de l’Académie entre Cadet et Baumé, sur les propriétés du mercure calciné, ou mercure précipité per se. Eut-il quelque pressentiment de sa découverte, ou fut-il favorisé par le hasard ? Lui-même va répondre : « Si, dit-il, je n’avais eu devant moi une chandelle allumée, je ne l’aurais pas plongée dans cet air, et toute la suite de mes expériences serait restée dans le néant ». Ainsi, d’après lui, c’est le hasard qui l’a servi ; mais hâtons-nous d’ajouter que c’est cette espèce de hasard qui n’accorde ses faveurs qu’à ceux qui les méritent. L’homme qui avait découvert neuf corps aériformes, qui avait inventé tous les appareils propres à les manier et à les étudier, qui le premier avait aperçu cette espèce d’équilibre providentiel entre les causes qui vicient l’air et les causes qui l’épurent, pouvait bien quitter sa modestie habituelle et se faire plus tard un mérite légitime de son immortelle découverte ; à la seconde, parce qu’elle y brûle avec éclat. Singulière tournure d’esprit ! A l’entendre, la chimie n’est pour lui qu’un loisir, et lorsqu’il reconnaît que sans l’oxygène il n’y aurait ni respiration, ni combustion, et que sa découverte est un véritable événement pour la science, il en attribue le mérite à une souris et à une chandelle : à la première, parce qu’elle s’y pâme d’aise ; à la seconde, parce qu’elle y brûle avec éclat] ».
L’analyse de l’air se trouve dans la VIe leçon (p. 101) : « Il est remarquable qu’en général on arrive aux grandes découvertes par des moyens très simples. » Hormis le nom de ballon donné au matras, la description de Malaguti est conforme à celle de Lavoisier : précautions, durée, proportion de gaz consommé. Les autres données numériques, inutiles pour les conclusions, sont passées sous silence. Malaguti respecte parfaitement l’expression de Lavoisier ; parlant de l’oxygène dégagé par la décomposition des lamelles rouges qui s’étaient formées à la surface du mercure calciné, il écrit : « Ce gaz, mêlée avec l’air de l’appareil, lui communiquait toutes les propriétés de l’air ordinaire ». Le dispositif représenté sur la gravure qui accompagne le récit est posé sur le pavement d’une paillasse et conforme à celui de Regnault.
Figure 13 : Illustrations de Malaguti, 1863.
@@@@@@@
En 1864, Alfred Naquet, élève de Wurtz, livre la première édition de ses Principes de chimie. Rédigé à Palerme où son auteur, appelé par Cannizzaro, est venu fonder une chaire de physique et chimie à l’Institut technique national, c’est le premier ouvrage de langue française exprimé dans la notation atomique. En appendice aux métalloïdes (non-métaux), c’est-à-dire après l’étude de l’azote et celle de l’oxygène, Naquet a placé un chapitre sur l’air atmosphérique :
Lavoisier prit un ballon B (fig. 31), dont il recourba deux fois le col très long ; dans le ballon il plaça du mercure et il engagea l’extrémité libre du col sous une cloche pleine d’air E, placée sur une cuve à mercure D. L’air contenu dans le ballon pouvait librement communiquer avec celui que renfermait la cloche. L’appareil étant ainsi disposé, Lavoisier chauffa pendant douze jours le ballon, à une température voisine du point d’ébullition du mercure. Il observa : 1 ° que le mercure du ballon se recouvrait d’une couche rouge ; 2 ° que le volume d’air de la cloche diminuait. […] Il reconnut alors que le gaz renfermé dans la cloche avait les propriétés que nous avons décrites comme appartenant à l’azote. Il recueillit, d’un autre côté, la couche rouge qui s’était produite, et il la chauffa fortement […]. Le mercure se régénéra, et il se dégagea un gaz auquel Lavoisier reconnut les propriétés que nous avons dit appartenir à l’oxygène. Enfin, en mélangeant le résidu de l’air avec le gaz dégagé par la calcination de la poudre rouge, il reconstitua de l’air atmosphérique avec toutes ses propriétés. Cette expérience capitale démontra que l’air est composé de deux gaz […] mais elle ne pouvait fixer que très approximativement sa composition quantitative.
Dans le chapitre sur l’oxygène, Naquet donne une méthode de préparation de ce gaz par décomposition de l’oxyde de mercure (II), appelé alors protoxyde de mercure, avec une équation en notation atomique :
On chauffe le protoxyde de mercure, qui se scinde en oxygène et en mercure.
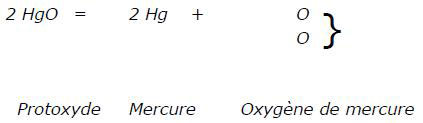
La flamme d’une lampe à alcool suffit pour cette opération qui s’exécute dans un petit tube fermé (fig. 18).
Figure 14 : Illustration de Naquet, 1864.
@@@@@@@
En 1875, paraît la troisième édition des Leçons de chimie appliquée à l’industrie, de Poiré. C’est un manuel « à l’usage des industriels, des écoles normales primaires, des établissements d’instruction primaire supérieure, des écoles professionnelles, des candidats au brevet de capacité, etc. » Délaissant l’objectif initial dépassé qui était de répondre à la question de savoir si l’air est un élément, l’auteur justifie l’intérêt porté à l’étude de l’air par un argument d’actualité :
On comprend en effet que la plupart des phénomènes chimiques se passant au milieu de l’air, il doit intervenir dans le plus grand nombre d’entre eux, et que sa part d’influence, comme les résultats de cette intervention, ne pourront être bien calculés et expliqués qu’autant qu’on connaîtra sa composition chimique.
Le résultat est connu depuis longtemps, inutile de faire semblant de le redécouvrir, l’auteur le rappelle donc avant d’exposer le protocole de Lavoisier.
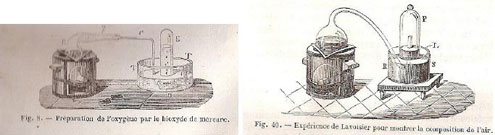
Figure 15 : Illustration de Poiré, 1875.
Du même auteur on trouve une Chimie (2e édition, 1883), à l’usage des candidats au baccalauréat ès sciences et aux écoles du gouvernement. Relativement aux versions antérieures de l’expérience de Lavoisier, Poiré a le souci d’éduquer ses lecteurs aux gestes techniques et à des pratiques de sécurité :
Dans une cornue B (fig. 9) on introduit une certaine quantité d’une poudre rouge appelée bioxyde de mercure. La cornue est fermée par un bouchon de liège, percé d’un trou à travers lequel passe un tube en verre, C, dit tube abducteur ; ce tube met la cornue en communication avec l’éprouvette D. On chauffe la cornue à l’aide de charbons contenus dans le fourneau, sur lequel elle est placée.
Notons que le nom de l’oxyde de mercure (II) retenu par Poiré situe son discours dans le cadre de la théorie des équivalents dans laquelle l’équivalent de l’oxygène étant 8, la formule contenait deux équivalents d’oxygène (bioxyde, 2x8) pour un équivalent de mercure (80). La gravure montre, soudé sur la partie horizontale du tube à dégagement, un tube de sécurité appelé tube de Welter T, dont la fonction est donnée :
Le tube de Welter est destiné à empêcher un phénomène que nous allons décrire et que l’on désigne sous le nom d’absorption. Supposons que le tube abducteur soit de la forme ordinaire et qu’on laisse éteindre le feu dans le fourneau, sans faire sortir de l’eau l’extrémité du tube. Les gaz contenus dans la cornue vont se refroidir ; leur force élastique diminuera, et la pression de l’atmosphère fera monter l’eau de la cuve dans le tube. Cette eau arrivant froide dans la cornue, pourra en déterminer la rupture, et même dans certains cas occasionner des explosions dangereuses. Le tube de Welter est destiné à remédier à cet inconvénient. Sur la branche horizontale du tube abducteur (fig. 11) est soudé un tube deux fois recourbé SSG ; la branche SG porte un renflement sphérique, et la branche SS, à son extrémité, un entonnoir S. On verse dans ce tube un peu d’eau, qui sert à isoler de l’atmosphère l’intérieur de l’appareil et qui est au même niveau dans les deux branches GS et SS, lorsque l’atmosphère de la cornue est à la pression extérieure. Mais lorsque la pression intérieure vient à diminuer, l’air extérieur refoule l’eau du tube dans le renflement sphérique et, montant lui-même à travers cette eau, rentre dans la cornue pour y rétablir l’équilibre de pression. Cela suppose évidemment que la branche verticale du tube abducteur est assez longue pour que l’air entre dans l’appareil par SSG, avant que la pression atmosphérique y ait poussé l’eau de la cuve.
Pour la première fois, nous rencontrons une autre représentation, qui est aussi une modélisation, sous la forme d’une équation de réaction.
Nous relèverons encore une tentative pour transmettre par écrit les gestes du métier, accompagnée de figures :
Quand l’éprouvette E est pleine de gaz, on introduit d’une main sous l’eau de la cuvette, une soucoupe (fig. 10) ; de l’autre main on soulève l’éprouvette de dessus le têt à gaz sans sortir de l’eau sa base inférieure, que l’on pose sur la soucoupe ; puis on sort de l’eau soucoupe et éprouvette. On a ainsi enlevé l’éprouvette sans permettre à l’air extérieur de se mêler au gaz qu’elle contient. Cela fait, on remplace la première éprouvette par une seconde, et ainsi de suite. Ce que nous venons de dire sur la manière de recueillir le gaz oxygène est général et s’appliquera aussi, dans la suite de ces leçons, à tout gaz se dégageant sur la cuve à eau ou sur la cuve à mercure.

Figure 16 : Illustration de Poiré, 1883.
Poiré conclut sur un argument économique, déjà utilisé par Cahours et Riche :
Le procédé de préparation que nous venons de décrire n’est guère employé ; il serait trop coûteux. Nous ne l’avons exposé que par suite de son importance historique, Priestley d’en étant servi pour découvrir l’oxygène.
Il rappelle ici sa détermination à faire place à l’histoire de la chimie, ce que confirment les notes de bas de pages consacrées à la biographie succincte des personnages cités.
@@@@@@@
La même année, 1883, paraît la quatrième édition du Cours de Chimie de Debray et Joly. L’expérience de Lavoisier est relatée dans le tome premier (p. 104). La masse de mercure est exprimée en unité actualisée : « Lavoisier prit un ballon de verre à long col, dans lequel il introduisit du mercure (120 gr.) ». Les auteurs simplifient les préparatifs en supposant la cloche graduée, et ils donnent des raisons de l’élévation du mercure dans la cloche, ici par pipetage : isolement, stabilité, visibilité du niveau, mesure de la pression :
Il mit alors une cloche graduée sur le mercure, de manière à emprisonner l’air du ballon, et pour que cette cloche pût tenir seule, et afin de pouvoir noter le volume de l’air emprisonné et sa pression, il aspira avec une pipette une portion de l’air de la cloche, ce qui permit au mercure de s’élever d’une certaine hauteur au-dessus de son niveau dans la cuve.
On ne fait pas encore de différence entre élément et corps pur simple :
L’air contient donc deux éléments : l’un, l’oxygène, qui lui donne la propriété d’entretenir la combustion et la vie des animaux ; l’autre, l’azote, qui tempère, sans modifier le résultat des combinaisons, l’action trop énergique de l’oxygène.
Corrigeant pour la première fois une propriété régulièrement et indûment attribuée au dioxygène pur depuis Lavoisier, celle d’entretenir la respiration, les auteurs sont plus réalistes que Malaguti sur le sort de la souris de Priestley immergée dans un bocal de ce gaz :
Si l’on place, en effet, dans une atmosphère d’oxygène un animal à respiration active, il meurt bientôt dévoré par une fièvre ardente. Les combustions ordinaires, que nous dirigeons au gré de nos désirs et d’après nos besoins, seraient au contraire impossibles à régler, si elles s’opéraient au contact d’une atmosphère illimitée d’oxygène, et deviendraient pour nous la source des dangers les plus grands.

Figure 17 : Illustration de Debray & Joly, 1883.
@@@@@@@
En 1883 encore, paraît la troisième édition de la Chimie de J. Henri Fabre, « à l’usage de tous les établissements d’instruction publique ». A l’époque de Lavoisier, en 1774, écrit-il (p. 34),
l’idée de Jean Rey était admise, mais il restait à découvrir si l’air était en entier absorbé par les métaux calcinés, ou s’il y avait une partie non absorbable ; il restait à déterminer enfin si l’air est un élément comme on l’avait cru jusqu’à lui, ou s’il renfermait des substances diverses. A cette découverte devaient s’en rattacher une foule d’autres avec lesquelles le génie de Lavoisier allait bientôt changer la face de la chimie, et faire une science admirable d’un recueil sans suite de préceptes d’atelier.
Le ton est enthousiaste : « Jamais expérience ne fut ni plus simple ni mieux conçue ». Quant aux propriétés de l’oxygène, une bougie soufflée s’y rallume « et de plus la combustion est si vive que la bougie, si on la laisse un peu de temps dans l’éprouvette, coule en grosses gouttes et s’use avec une dévorante activité ».
@@@@@@@
Armand Gautier, dans son Cours de chimie, (tome premier, 1887, p. 217), fait précéder l’expérience de Lavoisier d’un rappel des travaux de ses précurseurs, Jean Rey, Mayow, puis « en 1774 et 1775, Scheele et Priestley ».
Mais Lavoisier va paraître et éclairer de la lumière de son génie cette question toujours obscure de la constitution de l’air et des éléments eux-mêmes. En 1772 il observe que le soufre et le phosphore augmentent de poids en brûlant, et que cette augmentation provient de la fixation d’une quantité prodigieuse d’air.
On peut penser que Gautier tenait à faire commencer les travaux de Lavoisier avant ceux de Priestley et de Scheele, et à démarquer ses observations de celles de Rey.
En 1774, quelques mois après les premières recherches de Priestley sur la combustion et la respiration, Lavoisier calcine de l’étain […]. De 1774 à 1777 il refait à son tour, sans les connaître, les expériences de Mayow et de Priestley. C’est en 1777 enfin, que mettant à profit ces observations successives, il fait l’analyse complète de l’air, analyse si lucide, si magistrale, que nous ne saurions mieux faire que de la rapporter textuellement.
L’auteur explique l’expression, « la base de cette partie respirable », devenue très obscure pour ses contemporains, dans une note en bas de page :
Lavoisier veut par ces mots, désigner l’oxygène ayant perdu l’énergie calorifique qui se dégage au moment de la calcination du mercure. Cette profonde et juste conception de la constitution des éléments à l’état libre le préoccupa plus tard beaucoup ainsi que Laplace.
Regnault, l’un des premiers, signalait déjà la présence de dioxyde de carbone dans l’air. Gautier qui s’intéressait à la chimie biologique reprend :
Elle [l’expérience de Lavoisier] laissait d’ailleurs de côté la mesure de l’acide carbonique qu’on savait être versé dans l’atmosphère par la combustion, les fermentations, la respiration des animaux, ainsi que celle de la vapeur d’eau que Lavoisier n’ignorait pas exister à l’état de dissolution dans l’air ambiant. Il fut réservé aux continuateurs de ce grand homme de créer ou d’appliquer les méthodes propres à déterminer exactement la composition de l’air.
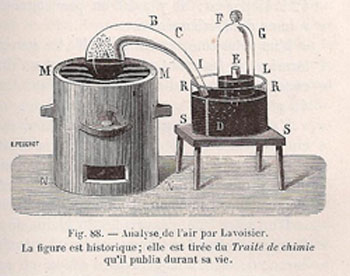
Figure 18 : Illustration de Gautier, 1887.
@@@@@@@
En 1891, le Précis de Chimie de Louis Troost en est à sa trente et unième édition. Dans le chapitre 2 sur l’Air (p. 26), on trouve un récit critique de l’expérience de Lavoisier à la fois très fidèle et actualisé relativement à la septième édition (1876) par la découverte des gaz rares :
Lavoisier a le premier fait connaître les deux principaux gaz qui entrent dans la composition de l’air. Il chauffait du mercure dans un ballon de verre (fig. 37) dont le col, très long et doublement recourbé, allait aboutir, en se relevant, jusque dans le haut d’une éprouvette graduée reposant sur une cuve à mercure, et aux trois-quarts remplie d’air. Au bout de quelques heures, il vit apparaître de petites pellicules rouges à la surface du mercure ; en continuant à chauffer pendant douze jours, il reconnut que les pellicules, qui avaient d’abord augmenté assez rapidement, cessaient de s’accroître. 1/6 environ du volume primitif avait disparu. Le gaz restant était impropre à la combustion et à la respiration : c’était le gaz découvert par Rutherford et qu’il avait appelé azote. Ce gaz est en réalité de l’azote mêlé avec environ 1/100 d’autres gaz, tels que l’argon (Lord Rayleigh et M. W. Ramsay), le krypton, le néon et le métargon (MM. W. Ramsay et Morris W. Travers). […] A la même époque, Scheele enleva à l’air son oxygène, au moyen des sulfures alcalins, et reconnut de même l’azote dans le résidu. Cette expérience était moins concluante que celle de Lavoisier, en ce qu’elle ne permettait pas de régénérer l’oxygène. […] il y a toujours dans l’air un peu de gaz carbonique et de vapeur d’eau. On constate l’existence du premier en exposant à l’air, dans un vaste plat, une dissolution limpide d’eau de chaux, qui bientôt se recouvre de pellicules blanches de carbonate de calcium. La présence de la vapeur d’eau peut être mise en évidence à l’aide d’un fragment de potasse caustique, qui se dissout peu à peu dans de l’eau qu’il absorbe. 40. Analyse de l’air. Les expériences de Lavoisier et de Scheele, tout en indiquant les principaux gaz qui entrent dans la constitution de l’air, ne peuvent pas donner les proportions de ces gaz : dans l’expérience de Lavoisier, une petite quantité d’oxygène reste libre ; dans celle de Scheele, un peu d’azote peut être absorbé.

Figure 19 : Illustration de Troost, 1876.
@@@@@@@
On retrouve une description rapide, sans schéma ni gravure, de l’expérience de Lavoisier dans les Leçons élémentaires de chimie moderne de Wurtz (sixième édition, 1892, p. 61), l’introduction est dogmatique :
L’air est un mélange d’oxygène et d’azote. Il renferme, en outre, quelques traces de gaz carbonique et des quantités variables de vapeur d’eau. Sa composition a été établie par Lavoisier dans une expérience demeurée célèbre.
Le résumé est sobre. Suit un couplet nationaliste représentatif de l’état d’esprit des savants français après la défaite de 1870. L’argument est d’autant moins convaincant qu’on sait que Lavoisier avait emprunté l’idée de l’oxyde de mercure à Priestley, que Wurtz ne cite pas :
Et combien cette expérience était plus démonstrative que celle entreprise par Scheele à la même époque ! Le grand chimiste suédois s’était contenté d’absorber l’oxygène de l’air par des sulfures alcalins. L’azote était resté comme résidu ; mais l’oxygène fixé sur le sulfure ne pouvait plus en être séparé. Au reste, ni l’une, ni l’autre méthode ne pouvait donner les proportions exactes suivant lesquelles l’oxygène est mêlé à l’azote dans l’air.
@@@@@@@
Au tournant du vingtième siècle, dans son Cours élémentaire de sciences physiques (p. 81), destiné aux candidats aux examens des Postes, télégraphes et téléphones, Louis Naud assure que le volume du gaz dégagé par le chauffage vigoureux de l’oxyde de mercure « représentait exactement le volume d’air absorbé par le mercure […] ». En outre, ce gaz « entretenait merveilleusement la combustion ».
Figure 20 : Illustration de Naud, 1900.
@@@@@@@
En 1903, l’Abbé Maillard produit un Cours élémentaire de Chimie, dans la notation atomique. L’expérience de Lavoisier y a sa place : « Un tube en forme de siphon est soudé au col d’un ballon qui contient du mercure ; l’autre extrémité s’engage sous une cloche renversée sur la cuve à mercure (fig. 76) ». Il retient cette précision expérimentale :
Le niveau dans la cuvette est un peu inférieur au niveau du mercure dans la cloche, afin que l’air dilaté par la chaleur ne s’échappe pas. On obtient ce résultat en aspirant un peu d’air de la cloche à l’aide d’un tube recourbé.
La conclusion est quantitativement étrange : « […] l’air était un mélange d’azote et d’oxygène dans les proportions de cinq sixièmes et d’un cinquième ».

Figure 21 : Illustration de Maillard, 1903.
@@@@@@@
Vient 1906, Maurice Blouet met à disposition des enseignants un petit livre intitulé Nouvelles manipulations de Chimie, pour les classe de seconde et première C et D, avec une préface de R. Lespiau. « Les programmes de 1902 ont donné à l’enseignement pratique des sciences expérimentales une importance qu’il n’avait pas. » Le chapitre 2 consacré à l’oxygène commence par une
Préparation de l’oxygène par la méthode de Priestley, appliquée par Lavoisier dans son analyse de l’air. – Dans un tube à essai particulièrement résistant, en verre vert un peu épais, on met deux ou trois centimètres cubes d’oxyde rouge de mercure. On chauffe. La poudre rouge noircit, puis elle se décompose en ses deux éléments : en oxygène qui se dégage et en mercure qui se condense, formant un anneau miroitant dans les parties restées froides du tube. […] Si on chauffe l’anneau miroitant, le mercure se volatilise et il va se déposer à nouveau dans les parois froides plus éloignées. On peut ainsi le faire voyager le long du tube. Les élèves pourront constater l’aspect de l’oxyde de mercure en masse importante dans le flacon. Ils le soupèseront pour constater son remarquable poids.
Aucune précaution n’est proposée pour éviter d’absorber les vapeurs de mercure. Mais « on aura soin de toujours tourner l’ouverture du tube dans une direction telle que, si des projections n’étaient pas évitées, elles ne puissent avoir de graves conséquences ».
Figure 22 : Illustration de Blouet, 1906 : Manière de chauffer un tube à essai.
@@@@@@@
En 1917 paraît le Nouveau cours de chimie élémentaire, de Matignon et Lamirand, pour les classes de philosophie A et B. Concernant Lavoisier :
Ses travaux […] nombreux et […] divers […] ont été inspirés par des considérations d’ordre pratique, ce qui montre bien que la Science n’a rien à craindre des préoccupations utilitaires. Il sut mettre en honneur les déterminations quantitatives.
Le récit de l’expérience insiste, en effet, sur les mesures : 0,62 l d’air emprisonné, 0,49 l de gaz restant, la masse du mercure avait diminué de 2,21g. Examinant le gaz restant, Lavoisier constatait que « le mercure à l’ébullition ne s’y "rouillait" plus ».
Prétendant de façon tout à fait inexacte à l’exactitude… les auteurs utilisent l’expérience pour démontrer le principe de la conservation de la matière :
Lavoisier a trouvé que : 2,39 g d’oxyde de mercure donnent par décomposition 2,21 g de mercure, 0,18 g d’oxygène ; La masse de l’oxyde de mercure est donc égale à la somme des masses de ses constituants. De même, en se reportant aux expériences de Lavoisier, on établit que : 0,78 g d’air referment 0,60 g d’azote et 0,18 g d’oxygène. La masse de l’air est donc égale à la somme des masses d’azote et d’oxygène correspondantes.
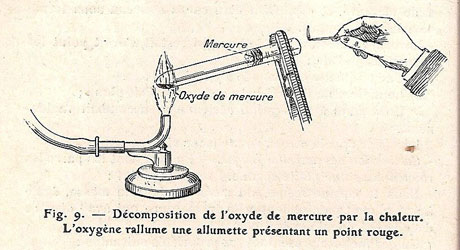
Figure 23 : Illustration de Matignon & Lamirand, 1917 : « L’oxygène rallume une allumette présentant un point rouge. »
@@@@@@@
En 1922 et 1923, Perseil et Gauthier-Echard publient un Cours de chimie à l’usage des Écoles primaires supérieures et cours complémentaires, pour la préparation au Brevet élémentaire et aux écoles normales. L’expérience de Lavoisier figure p. 13-16. En note, cette présentation de Lavoisier : « […] célèbre chimiste français ; le créateur de la chimie ».
Figure 24 : Illustration de Perseil et Gauthier-Echard, 1922.
@@@@@@@
En 1925, dans son Précis de chimie (p. 9) qui s’adresse aux mêmes élèves, Metral décrit l’expérience au présent comme s’il était en train de la faire :
On chauffe à une température un peu inférieure à la température d’ébullition du mercure, et l’on voit la surface de ce corps se recouvrir, lentement, de petits grains rouges.
Par un souci louable d’en appeler à l’expérience des élèves qui connaissent l’altération du fer en contact avec l’air humide, il appelle rouille le produit de la calcination du mercure dans l’air :
Après cinq ou six jours, la quantité de rouille n’augmentant plus […]. Le gaz restant […] n’est plus susceptible de produire la « rouille » du mercure à chaud.
Figure 25 : Illustration de Métral, 1925.
@@@@@@@
En 1929, l’expérience est décrite dans la Chimie d’E. Escal (p. 2) destinée aux mêmes lecteurs. Le texte est accompagné d’une schématisation assez fidèle de la gravure de Regnault. L’auteur commence par de sèches définitions et donne de la visibilité aux sentences et aux mots qu’il juge importants en adoptant pour eux des caractères gras et italiques :
Pour déterminer la composition d’un corps, on en fait l’analyse. Analyser un corps, c’est le décomposer en ses éléments. L’analyse est qualitative si l’on se propose simplement de connaître la nature des éléments constitutifs du corps ; elle est quantitative si l’on détermine, en outre, la proportion suivant laquelle ces éléments sont unis. Les résultats de l’analyse peuvent être contrôlés par la synthèse du même corps. Faire la synthèse d’un corps, c’est le reconstituer à l’aide de ses éléments. Le produit obtenu est dit synthétique, par opposition au produit naturel ou au produit extrait des substances qui le renferment. L’air a été longtemps considéré comme un corps simple ; c’est Lavoisier qui le premier, en a établi la composition par une expérience célèbre.
Une note de bas de page présente Lavoisier : « Il a reconnu la composition de l’air et de l’eau ». Elle a le tort de placer la composition de l’eau (corps pur composé ou combinaison chimique) sur un plan équivalent à celle de l’air (mélange) et elle ne prépare pas les lecteurs à distinguer l’analyse immédiate de l’analyse élémentaire. La définition que l’auteur donne de l’analyse est celle de l’analyse élémentaire (d’une combinaison) et celle qu’il donne de la synthèse est celle d’une combinaison, toutes deux inappropriées à l’étude de l’air qui est un mélange.
C’est la première fois que nous rencontrons un auteur qui fait la remarque que nous soulignons : « Le ballon contenait une petite quantité de mercure ». La description respecte les expressions prudentes de Lavoisier.
Lavoisier recueillit les parcelles rouges et les chauffa dans une petite cornue munie d’un tube à dégagement ; il obtint ainsi un gaz dont le volume était égal à celui qui avait disparu de la cloche ; en même temps, les parois de la cornue se tapissaient de gouttelettes brillantes de mercure.
Cette figure est un schéma que nous rencontrons pour la première fois : on y voit un tube à essais incliné dans la flamme sortie d’un tuyau et contenant quelques parcelles d’oxyde de mercure. A mi-hauteur des points simulent des gouttelettes de mercure et, enfoncée à l’entrée du tube, on voit une baguette ou allumette enflammée. Les noms, oxyde de mercure, mercure, oxygène, sont indiqués en toutes lettres au bout de traits pointillés partant des matières désignées ou de la lumière du tube. L’expérience ainsi représentée a fait longtemps l’objet d’une expérience de cours et de travaux pratiques, jusqu’à ce qu’on s’avise de la toxicité des vapeurs de mercure.
L’auteur propose, après chaque chapitre, un résumé, un questionnaire, des sujets de devoirs et des exercices, parmi les questions, celle-ci : « Décrire l’expérience de Lavoisier. Pourquoi les résultats de cette expérience ne sont-ils pas rigoureusement exacts ? » (édition 1930, p. 8).
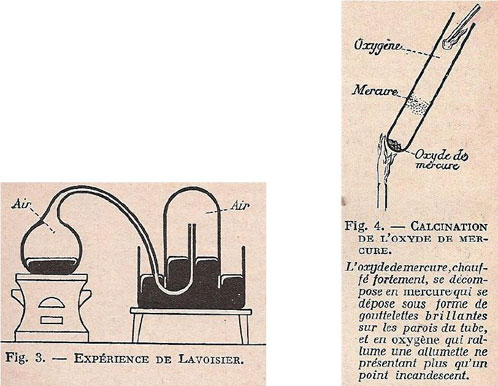
Figure 26 : Illustration de Escal, 1929.
@@@@@@@
En 1920, l’expérience de Lavoisier figurait explicitement dans les programmes d’enseignement : il n’en est plus de même à partir de 1945. Néanmoins les auteurs ne délaissent pas sa description. En 1947, Lamirand, Annequin et Chamfy dans leur Chimie, destinée aux cours complémentaires, font appel, sous forme de lectures fournies, à une biographie de Lavoisier (p. 8-10) et à un extrait de ses mémoires (p. 37-39).
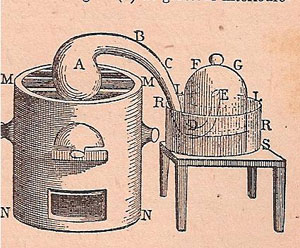
Figure 27 : Illustration de Lamirand et al., 1947.
En 1953, Lazerges, Legris et Dechêne, dans leur Cours de chimie (Classe de Seconde C et Moderne, p. 37) entrecoupent leur récit de citations de Lavoisier :
Pendant la première journée, Lavoisier observe uniquement la distillation du mercure vers les parties froides de l’appareil […] Le second jour, le mercure commence à fixer l’oxygène en formant un corps nouveau constitué par des parcelles rouges.
Et, dans la seconde partie du récit :
Lavoisier rassemble les parcelles rouges qui se font formées sur le mercure, les place dans une petite cornue équipée de manière qu’on puisse recueillir les gaz qui se dégageront et les chauffe à une température plus élevée que dans la première partie de l’expérience.
Puis l’interprétation :
Le mercure a donc la propriété de fixer l’oxygène ou de le restituer suivant la température à laquelle on chauffe. Il n’en est pas de même du phosphore : le phosphore fixe l’oxygène en formant de fumées blanches ; mais il est impossible ensuite de redécomposer ce solide blanc en phosphore et oxygène. Le mercure permet donc une expérience plus complète. Par contre, l’oxygène est fixé moins complètement : dans l’expérience de Lavoisier, le volume a diminué de 1/6 au lieu de 1/5, ce qui montre que l’oxygène de l’air n’avait pas été complètement absorbé.
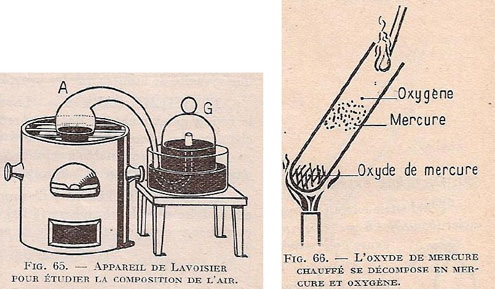
Figure 28 : Illustration de Lazerges et al, 1953.
@@@@@@@
En 1954, dans la Chimie de G. Legreneur et M. Peyraud, à l’usage de la classe de quatrième de l’enseignement technique commercial, (5e chapitre, p. 37), les auteurs reprennent à leur compte l’analogie entre l’oxydation du mercure et celle du fer :
Vers 1774 Lavoisier entreprend des recherches sur la cause de l’altération subie par certains métaux au contact de l’air : le fer rouille, le plomb se ternit ; chauffé le mercure lui-même s’altère superficiellement. Lavoisier pense que l’air joue un rôle actif dans ces transformations, et il imagine de chauffer du mercure en présence d’une quantité d’air limitée.
À la suite, avec quelques invraisemblances, ils décrivent l’expérience, qualifiée de « fondamentale » :
Il [Lavoisier] mesure le volume de l’air ainsi isolé dans la cornue et dans la cloche. […] Le deuxième jour, la surface du métal commence à se couvrir de paillettes rouges, sorte de rouille de mercure.
Rappelons à nouveau qu’en 1954 on ne distingue pas encore l’élément du corps pur simple, parlant du gaz restant les auteurs écrivent donc : « L’azote est un corps simple ; son symbole est N ». N est le symbole de l’élément, N2 la formule du corps pur simple. « Lavoisier recueille la couche de rouille de mercure ». À cette date, on écrit OHg la formule de l’oxyde rouge. Le chapitre est suivi d’une longue lecture du texte de Lavoisier (1775).

Figure 29 : Illustrations de Legreneur & Peyraud, 1954.
@@@@@@@
Vers 1960, dans leur Chimie de seconde C, C’, M et M’ (p. 26), Eve et Langlois donnent de l’expérience de Lavoisier le compte rendu suivant. Ils rappellent d’abord le résultat : « L’air est surtout formé d’azote et d’oxygène dans la proportion en volumes de 4/5 d’azote et 1/5 d’oxygène ». La relation de l’expérience est organisée en deux parties, 1°/ Analyse de l’air, 2°/ Reconstitution de l’air. La première partie est elle-même subdivisée en trois, le récit de l’expérience historique, une conclusion et interprétation de cette expérience, et une expérience pouvant être réalisée aujourd’hui. Certes, cette organisation traduit le souci des auteurs de structurer la leçon et partant, d’imprimer cette structuration à la mémoire de leurs lecteurs. Dans cet ouvrage et dans le précédent, il en résulte néanmoins une rigidité et une dépersonnalisation du discours qui ne témoigne pas exactement des voies par lesquelles la chimie se construit : intuition, analogie, concurrence (voir Malaguti). Le texte est accompagné de deux schémas très semblables aux précédents. Cependant dans la représentation du ballon, Escal indiquait la présence d’air dans celui-ci et dans la cloche, tandis qu’Eve et Langlois indiquent celle du mercure dans le ballon, dénommé cornue dans le texte, et dans la cuve. Le choix du premier est à coup sûr plus pertinent, compte tenu des objectifs de l’expérience : analyser l’air et fixer l’attention du lecteur sur lui. Mais voici la suite :
Lavoisier chauffait du mercure dans une cornue dont le col, deux fois recourbé, se rendait dans une cloche renversée sur la cuve à mercure (fig. 21). L’air contenu dans la cornue, le tube recourbé et la cloche, était ainsi séparé de l’air extérieur par le mercure de la cuve. L’expérience dura douze jours.
Les auteurs citent Lavoisier : « Le second jour […] j’ai laissé refroidir les vaisseaux ». Puis, « Après refroidissement, le volume du gaz contenu dans la cornue et dans la cloche avait diminué de 1/5 environ ». À nouveau ils citent Lavoisier : « L’air qui restait […] plongées dans l’eau », ajoutant :
A ce gaz, Lavoisier donne le nom d’azote (sans vie). Enfin, la masse du mercure qui avait été placée dans la cornue avait diminué.
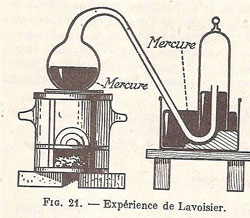
Figure 30 : Illustration de Eve & Langlois, non daté, ca. 1960.
Un rapide calcul montre que la diminution de masse du mercure, environ 2 g, n’atteignait pas 2 % de la masse initiale, elle était donc difficile à mettre en évidence ; au contraire, la diminution de volume de l’air dépassait 150 cm3, 16% du volume gazeux total, entièrement reportés sur le volume du gaz dans l’éprouvette. Contrôler la variation de masse du mercure n’était certainement pas le bon moyen d’exploiter cette expérience, et on l’a vu, ce ne fut pas celui choisi par Lavoisier. Pourquoi les auteurs l’ont-ils privilégié ? Par souci d’originalité ? Indépendamment d’une méconnaissance des méthodes expérimentales et de la déontologie en matière historique, ce choix témoigne en tout cas, de leur part, d’un certain éloignement du laboratoire qui les a privés d’esprit critique expérimental envers le mode opératoire qu’ils choisissaient. Ils continuent d’ailleurs dans la même voie :
En chauffant fortement les paillettes rouges qu’il avait recueillies, Lavoisier les voyait disparaître et il obtenait une masse de mercure égale à celle qui avait disparu dans la cornue, ainsi qu’un dégagement d’oxygène.
La conclusion est originale, mais seule la seconde assertion est bien démontrée par l’expérience de Lavoisier : « L’oxygène et le mercure sont des corps simples ; l’oxyde de mercure est un corps composé ».
@@@@@@@
En usage à peu près à la même date, on peut consulter la Chimie d’Eurin et Guimiot (classe de seconde AA’B, p. 10). Rappelant la formation de la rouille, ils font d’abord appel aux connaissances du lecteur, et donnent de Lavoisier l’image d’un chercheur organisé qui ne laisse rien au hasard :
L’altération de certains métaux à l’air, comme la rouille du fer, était connue depuis longtemps. Lavoisier eut l’idée d’attribuer la formation de cette rouille à l’action d’un corps contenu dans l’air et, pour vérifier cette hypothèse, imagina l’expérience suivante. […] À la température ambiante le mercure ne « rouille » pas, mais en chauffant plusieurs jours, on peut observer l’apparition d’une [sic] pellicule rouge à sa surface. Dans l’expérience de Lavoisier (fig. 10), au bout de 12 jours, le phénomène semblait terminé et, après refroidissement, le volume du gaz restant dans l’éprouvette n’était plus que les 4/5 du volume initial.
On peut douter de la pertinence de perpétuer l’image de la rouille ; les auteurs prennent le risque d’amener le lecteur à confondre les deux oxydes, d’autant que leurs couleurs s’y prêtent, comment comprendrait-il que le mercure engendre un oxyde de fer ?
Ce gaz était très différent de l’air initial : il éteignait une allumette [NB : anachronisme], ou tout corps enflammé, comme le bois ou le papier. Le mercure à l’ébullition ne s’y rouillait pas et un oiseau y mourait rapidement. Lavoisier appela ce gaz azote (sans vie) parce qu’il n’entretient pas la vie. Reprenant ensuite la pellicule rouge qui recouvrait le mercure, Lavoisier calcina ce produit dans une cornue, et il put recueillir du mercure et un gaz de volume égal à celui qui avait disparu dans la première partie de l’expérience. Ce gaz rallumait une allumette ne présentant plus qu’un point incandescent, rouillait facilement le mercure à l’ébullition ; un oiseau y vivait, mais été très agité. Lavoisier appela ce gaz « air éminemment respirable » puis « air vital » et enfin oxygène (qui engendre les acides). La pellicule rouge que Lavoisier appelait la « chaux » du mercure s’appelle aujourd’hui de l’oxyde de mercure.
Les auteurs énoncent deux conclusions de cette expérience, en réalité la seconde n’appartient pas à Lavoisier :
L’expérience de Lavoisier a montré que l’air contenait deux gaz : l’azote et l’oxygène. Les volumes d’azote et d’oxygène sont entre eux dans les proportions de 4 à 1. Poursuivant ses expériences en mélangeant ensemble de l’azote et de l’oxygène dans les proportions de quatre volumes d’azote pour un volume d’oxygène, Lavoisier obtint de l’air « en tout semblable à celui de l’atmosphère ».
N’ayant jamais employé jusque là le mot analyse, les auteurs font cette remarque justifiée :
Cette reconstitution de l’air est quelquefois appelée une synthèse de l’air, mais nous préfèrerons conserver cette dénomination pour la production d’un corps pur et non d’un mélange.
Malheureusement, aussitôt après, ils intitulent le paragraphe suivant : « Analyse de l’air par le phosphore », sans distinguer l’analyse immédiate d’un mélange de l’analyse élémentaire d’une combinaison.
De façon originale cet ouvrage propose des lectures en fin des chapitres. On y trouve (p. 14-15) des extraits du texte de Lavoisier. En notes de bas de page sont indiquées les correspondances entre pouce cubique, ligne, pouce et unités du système métrique, entre grain et centigramme. Sont jointes trois courtes notices biographiques de Priestley, Scheele et Lavoisier. Ce sont dans leur brièveté de petits chefs-d’œuvre d’une présentation « engagée » de la science. La notice sur Priestley conduit à perpétuer de lui l’image habituelle et inexacte d’un amateur chanceux, dont les découvertes, désignées par d’anciens noms, sont, comme leurs vocables, périmées :
Priestley (Joseph) : 1733-1804. Théologien et médecin anglais, réussit de remarquables découvertes en chimie : air nitreux (oxyde azotique) – air phlogistiqué (azote) et air déphlogistiqué (oxygène). Il prépare l’oxygène en 1774 par décomposition de l’oxyde de mercure (précipité per-se).
La biographie de Scheele est sensiblement moins réductrice que dans certains manuels antérieurs :
Scheele (Karl Wilhelm) : 1742-1786. Chimiste suédois. On lui doit de nombreuses découvertes : chlore, manganèse, la baryte et de nombreux acides. Il découvrit l’oxygène probablement avant Priestley et Lavoisier par décomposition de l’oxyde de mercure, de l’oxyde d’argent.
La gloire de Lavoisier n’ayant rien à redouter de ce savant apothicaire qui, disparu en 1786, n’a jamais rien revendiqué, les chimistes français l’ont souvent « utilisé » comme une « troisième force » dans la polémique « en recherche de paternité » entre Priestley (la Grande-Bretagne) et Lavoisier (la France).
Enfin vient Lavoisier, sans nationalité donc universel, pour lequel les auteurs invoquent le témoignage d’un (autre) grand ancêtre populaire :
Lavoisier (Antoine Laurent) : 1743-1794. Fondateur de la Chimie Moderne : introduisit en chimie, selon une expression de Pasteur, l’esprit de la physique, science des mesures précises.
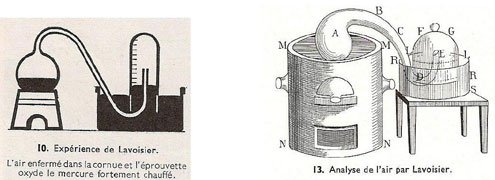
Figure 31 : Illustration de Eurin & Guimiot, 1961.
@@@@@@@
En 1962, dans 700 expériences de cours de chimie, Remy-Genneté propose deux fois l’expérience de décomposition de l’oxyde de mercure II, l’une dans un gros tube à essais en pyrex pour illustrer les propriétés de l’oxyde HgO (p. 631), l’autre dans une cornue en verre vert ou peu fusible comme méthode de préparation du dioxygène (p. 56).
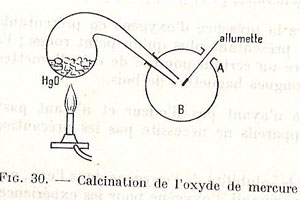
Figure 32 : Illustration de Rémy-Genneté, 1962.
Dix ans plus tard, Chatelet et Guihaumé ne donnent plus que l’équation de décomposition thermique de l’oxyde de mercure dans le chapitre sur l’oxygène (p. 101) de leur Chimie expérimentale – chimie minérale : HgO = Hg + ½ O2
@@@@@@@
Souil et Leboutet, en 1991, dans leurs Expériences de chimie (tome 2, chimie minérale, p. 26) destinées à la préparation du CAPES, proposent l’expérience de décomposition thermique de l’oxyde HgO, sous le titre « Une expérience historique » dans le montage sur le dioxygène, le mot définitif est confirmé, désormais l’expérience de Lavoisier n’a plus d’intérêt qu’historique et la crainte d’intoxications par le mercure va contribuer à l’éliminer tout à fait de l’enseignement. Ces auteurs s’intéressent au résidu, ils donnent des conseils de prudence et des conseils pédagogiques abrégés et ils résument l’opération par une nouvelle équation-bilan :
Par chauffage modéré d’un peu d’oxyde rouge de mercure dans un tube à essais (sous la hotte : danger des vapeurs de mercure
(9)) on obtient du dioxygène (montrer) et un solide noir qui est un sous-oxyde de mercure ; la réaction est réversible : n HgO = Hg
xO
y + O
2 (g) Si l’on chauffe plus fort on aboutit au mercure. C’est l’expérience « inverse » de celle de Lavoisier. On sait qu’il chauffa 12 jours en vase clos un volume connu de mercure en présence d’air. A la fin de l’expérience il put constater qu’un cinquième de l’air avait disparu ; le résidu n’entretenant plus la combustion, il l’appela azote. La proportion de dioxygène dans l’air fut ainsi déterminée avec une bonne précision. Des taches rouges (d’oxyde) s’étaient formées à la surface du mercure.
Si la falsification du taux d’oxygène de 1/6 à 1/5 est commune à de nombreux auteurs, ceux-ci sont les premiers à prétendre que l’expérience ait conduit à la déterminer « avec une bonne précision » !
@@@@@@@
L’année suivante, dans ses Expériences de chimie, destinées aux candidats à l’agrégation de sciences physiques (Compléments de chimie inorganique, p. 86) et dans le montage sur « Le mercure et ses composés », Souil propose d’étudier l’oxydation du mercure pour illustrer le diagramme d’Ellingham. Sans référence à Lavoisier il écrit :
La réaction est réversible à 350 °C. Chauffer un peu de mercure dans une coupelle (vapeurs dangereuses, hotte obligatoire). Il se fait Hg2O gris : 2 Hg + ½ O2 = Hg2O. Chauffer plus fort ; on obtient l’oxyde rouge HgO. Hg2O + ½ O2 = 2 HgO Au-dessus de 350 °C l’oxyde se dissocie.
Conclusions
Au cours de ce voyage de manuel en manuel, nous avons vu la double expérience de Lavoisier diversement exploitée : par les uns en théoriciens, pour établir ou illustrer les lois de la chimie, par d’autres pour enseigner des méthodes, des gestes, des savoirs expérimentaux. Conçue pour répondre à une question aussitôt périmée – l’air est-il un élément ? – l’expérience de Lavoisier, actualisée, réécrite de génération en génération, a connu d’autres objectifs fondamentaux : - distinguer le mélange de la combinaison chimique, - distinguer le corps pur simple de l’élément, - isoler une espèce chimique (le diazote par analyse immédiate de l’air) - préparer une espèce chimique (le dioxygène par chauffage de l’oxyde de mercure II)
Les figures, dessins, schémas ou photographies, témoignent des évolutions de matériels : types de fourneaux, lampe à alcool, becs de gaz, cloche et éprouvette, enfer de Boyle, matras, cornue, ballon et tubes à essais. Elles indiquent aussi une autre évolution : les témoins directs deviennent rares, ceux qui n’ont pas vu ni expérimenté eux-mêmes ne prêtent plus attention aux proportions du dispositif. Produire un schéma d’une expérience qu’on a vue est un exercice structurant, mais donner a priori un schéma qui dissimule les gestes du métier n’enseigne pas à concevoir un dispositif fonctionnel.
Les auteurs mettent en scène plusieurs façons d’enseigner : ils plaident, racontent, décrivent, rapportent, classent ou découpent, ordonnent. Le souci pédagogique peut devenir maladresse (la rouille), et l’excès de repères (paragraphes numérotés, définitions dogmatiques) peut tuer l’imagination. La permanence des faits n’efface pas la contingence des présentations. Celles-ci traduisent la concurrence entre chercheurs ou le nationalisme d’une époque qui n’épargne pas les scientifiques. Certains auteurs ne sont ni fidèles ni rigoureux lorsqu’il s’agit de rapporter des faits historiques. Les personnalités s’expriment, enthousiastes ou rigides ; on entrevoit des intérêts divers, l’interaction de la chimie avec le vivant (air respirable), l’environnement, la sécurité.
Des questions permanentes sont posées : certains s’efforcent de situer la science dans une histoire, pour d‘autres elle est intemporelle. Pour les uns la découverte procède du hasard, pour d’autres de la planification. L’examen proposé ici, sur un seul exemple, l’expérience historique de Lavoisier, pourra inciter les professeurs à choisir plus consciemment les modèles qu’ils souhaitent reproduire dans leur pratique et à écarter les erreurs de langage.
Février 2013

(1) Le dispositif du « matras » et le choix de l’oxyde de mercure sont des idées de Priestley – on aurait pu imaginer un autre produit pour montrer l’absorption d’un constituant de l’air, comme par exemple phosphore, voir ci-dessous Bouchardat p. 16.
(2) Auj. mofette, émanation gazeuse malodorante.
(3) On appelle de nos jours diazote la molécule N2 présente dans l’air.
(4) Chaptal, Elémens de Chymie, seconde édition, tome I, p. 90, 1794.
(5) Elémens de Chymie Pratique, t. 1er, Paris, 1751.
(6) Elémens de Chymie, 2nde édition, t. 2, p. 372, 1994.
(7) L’étymologie du mot azote (a- privatif, gr. zoos, être vivant, cf. zoologie) explique ceci. Seul le français continue à utiliser le terme de Lavoisier – la quasi-totalité des autres langues utilise le terme nitrogène (d’où vient aussi le symbole chimique N)
(8) Traité des essais par la voie sèche, tome 1er, planche IV, fig. 3, Moyens de recueillir les Gaz et les Vapeurs, 1848).
(9) L’auteur s’exprime « en abrégé » dans son manuel.














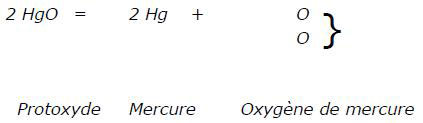


![]()


















 La première édition du Traité (1789) en ligne sur Gallica
La première édition du Traité (1789) en ligne sur Gallica 











